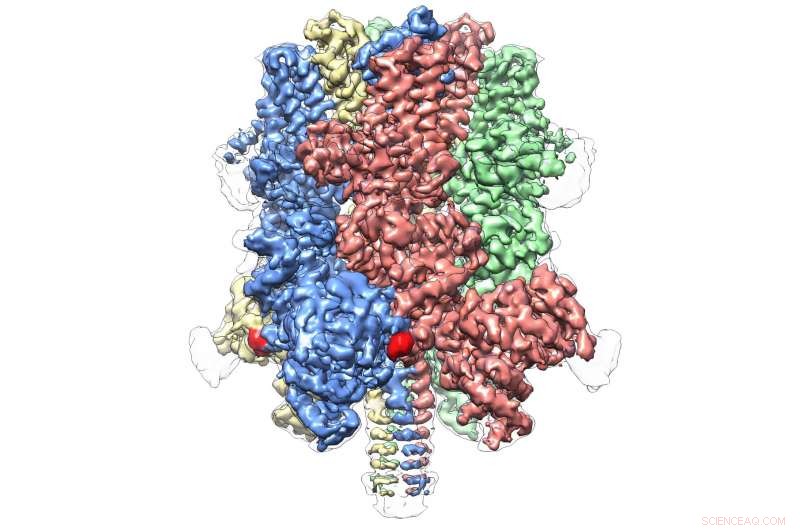
El TRPM4 humano se unió al agonista Ca + y al modulador DVT a 3,8 Å. Crédito:Wei Lü, Doctor.
Un equipo dirigido por científicos del Instituto de Investigación Van Andel (VARI) ha revelado por primera vez la estructura a nivel atómico de un objetivo farmacológico prometedor para afecciones como el accidente cerebrovascular y la lesión cerebral traumática.
Llamado TRPM4, esta proteína se encuentra en los tejidos de todo el cuerpo, incluido el cerebro, corazón, riñón, colon e intestinos, donde juega un papel importante en la regulación del flujo sanguíneo a través de la constricción de los vasos sanguíneos, así como en el establecimiento del ritmo cardíaco y la moderación de las respuestas inmunitarias.
"Comprender el papel que juega TRPM4 en la regulación de la circulación es vital, pero durante años la investigación se ha visto limitada por la falta de conocimientos sobre su arquitectura molecular, "dijo Wei Lü, Doctor., profesor asistente en VARI y autor principal de un estudio que describe la estructura de TRPM4, publicado hoy en Naturaleza . "Nuestros hallazgos no solo brindan una descripción detallada, mapa a nivel atómico de esta proteína crítica, pero también revelan facetas completamente inesperadas de su composición ".
TRPM4 participa de manera crítica en la regulación del suministro de sangre al cerebro, que comprende solo alrededor del 2 por ciento del peso total del cuerpo, pero recibe del 15 al 20 por ciento de su suministro de sangre. Condiciones que interrumpen el flujo sanguíneo en el cerebro, como accidente cerebrovascular, lesión cerebral traumática, edema cerebral e hipertensión, pueden tener consecuencias devastadoras y son problemas importantes de salud pública.
"Existen muchas salvaguardias en el sistema circulatorio del cerebro para proteger contra una interrupción repentina del suministro de sangre, uno de los cuales es TRPM4, ", Dijo Lü." Esperamos que una mejor comprensión de cómo se ve esta proteína dé a los científicos un modelo molecular en el que basar el diseño de medicamentos más eficaces con menos efectos secundarios ".
La estructura de TRPM4 es marcadamente diferente de las otras moléculas de la superfamilia TRP, una categoría de proteínas que median las respuestas a sensaciones y estímulos sensoriales, como el dolor, presión, visión, temperatura y sabor. Ampliamente conocido como canales iónicos, proteínas como TRP se anidan dentro de las membranas de las células, actuando como guardianes de las señales químicas que entran y salen de la célula.
Incluso dentro de su propia subfamilia, que comprende ocho moléculas en total, TRPM4 parece ser completamente único. La publicación de hoy representa la primera vista atómica de un miembro de la subfamilia TRPM.
Revela una estructura en forma de corona, con los cuatro picos que componen un gran dominio N-terminal, un sello distintivo de las proteínas TRPM. Esta región, que se encuentra al comienzo de la molécula, es un sitio importante de interacción con el entorno celular y otras moléculas del cuerpo. En el extremo opuesto de TRPM4, comúnmente llamado dominio C-terminal, El equipo de Lü encontró una estructura en forma de paraguas sostenida por un "poste" y cuatro "nervaduras" helicoidales, características que nunca antes se habían observado.
Los hallazgos fueron posibles gracias a la moderna suite de microscopía crioelectrónica avanzada David Van Andel de VARI, lo que permite a los científicos ver algunos de los componentes más pequeños de la vida con exquisito detalle. El microscopio más grande de VARI, el titán krios, es uno de menos de 120 en el mundo y es tan poderoso que puede visualizar moléculas 1/10, 000th del ancho de un cabello humano.
La estructura de Lü es la segunda estructura molecular determinada en el Krios del Instituto desde que se completó la instalación de la suite a principios de este año.