Figura 1. Concepto de diseño de un nuevo formato de fragmento de anticuerpo “Fv-clasp”. Fv-clasp es una fusión simple del dominio SARAH derivado de la proteína Mst1 humana al Fv (verde:cadena pesada, cian:cadena ligera) fragmento de un anticuerpo. El dímero VH / VL se estabiliza mediante la conformación dímera del dominio SARAH (magenta oscuro y claro). Crédito:Universidad de Osaka
Los anticuerpos son un poderoso sistema de armas para defender nuestro cuerpo contra invasores como bacterias y virus. Cada anticuerpo consta de cuatro cadenas polipeptídicas de aminoácidos:dos cadenas pesadas y dos cadenas ligeras unidas para formar una molécula en forma de Y. Los anticuerpos reconocen un antígeno específico exclusivo de su objetivo, ya que poseen los sitios de unión al antígeno ubicados en las puntas superiores de la Y. Si bien las terapias basadas en anticuerpos se han establecido como fármacos de primera línea, Se ha avanzado poco en el uso de anticuerpos como herramientas de investigación en el descubrimiento de fármacos de moléculas pequeñas. particularmente en el campo de la cristalografía de rayos X.
La cristalografía de rayos X es una técnica que utiliza patrones de difracción de rayos X para determinar estructuras tridimensionales de moléculas como proteínas, pequeñas moléculas orgánicas, y materiales. El principal desafío en los enfoques de cristalografía de rayos X sigue siendo la producción de cristales difractantes de alta calidad.
En años recientes, Existe un uso creciente de fragmentos de anticuerpos como chaperonas de cristalización para ayudar a la determinación estructural de proteínas diana "no cristalizables" o "no farmacológicas". La base de la estrategia es aumentar la probabilidad de obtener cristales bien ordenados minimizando la heterogeneidad conformacional en la proteína diana.
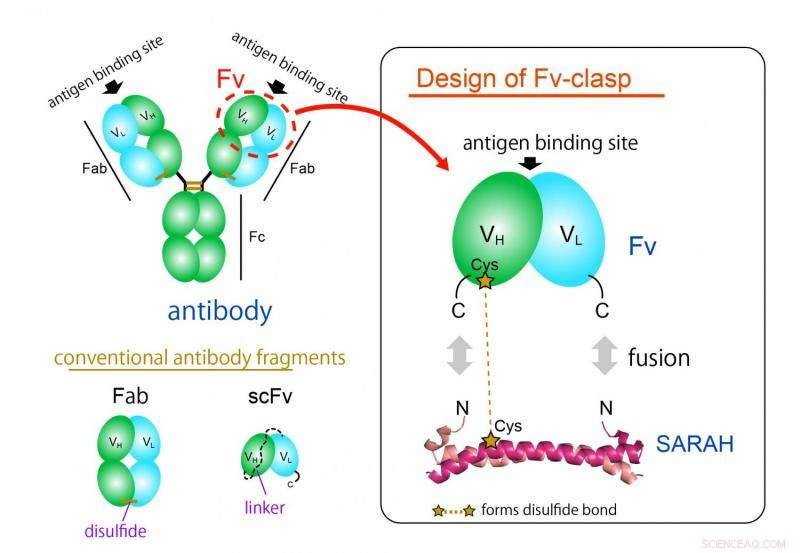
El formato de fragmento de anticuerpo más utilizado es el formato Fab, pero es difícil de producir en sistemas de expresión bacterianos debido a su estructura grande y compleja. El fragmento Fv del anticuerpo, que contiene solo una cadena pesada y una ligera, Sería ideal para esta aplicación gracias a su arquitectura simple y pequeña. Sin embargo, Fv rara vez se usa porque las dos cadenas se disocian fácilmente, conduciendo a una pérdida de función.

Figura 2. Estructura cristalina de cierre Fv. Estructura tridimensional real del cierre Fv determinada por análisis cristalográfico de rayos X. Crédito:Universidad de Osaka
Ahora, un equipo de investigadores de la Universidad de Osaka ha diseñado un nuevo fragmento Fv monocatenario con una compatibilidad de producción mejorada, estabilidad y cristalizabilidad, mientras se mantiene la capacidad de unión de la molécula original. Recientemente publicaron sus hallazgos en Structure.
"Producimos con éxito un nuevo fragmento fusionando una estructura de espiral en espiral antiparalela derivada de un dominio particular de una enzima humana, Quinasa Mst1, a los sitios de unión al antígeno de un anticuerpo, "explica el autor principal del estudio, Takao Arimori." La molécula quimérica resultante, Fv-broche, era funcional y estructuralmente equivalente al Fv del anticuerpo original ".
Notablemente, el cambio del formato Fab al Fv-clasp mejoró notablemente la cristalización asistida por anticuerpos de dos proteínas biológicamente importantes, los dominios extracelulares integrina a6b1 y sorLasorLA. La integrina a6b1 desempeña un papel importante en la unión de las células iPS y las células madre embrionarias, así como de muchas células de cáncer de hígado a la membrana basal. una base de red de proteínas extracelulares presente en los tejidos en la mayoría de las células y órganos, mientras que sorLA es un receptor de proteína implicado en la enfermedad de Alzheimer.
"La aplicabilidad universal del diseño de cierre Fv a la producción a gran escala y económica lo hace deseable para aplicaciones industriales. Además, su alta estabilidad térmica es una gran ventaja para las inmunoterapias, ", dice el autor correspondiente Junichi Takagi." Aparte del campo de la biología estructural, anticipamos que el diseño de cierre Fv contribuirá a la expansión del ya eminente uso de anticuerpos en las ciencias básicas y aplicadas ".