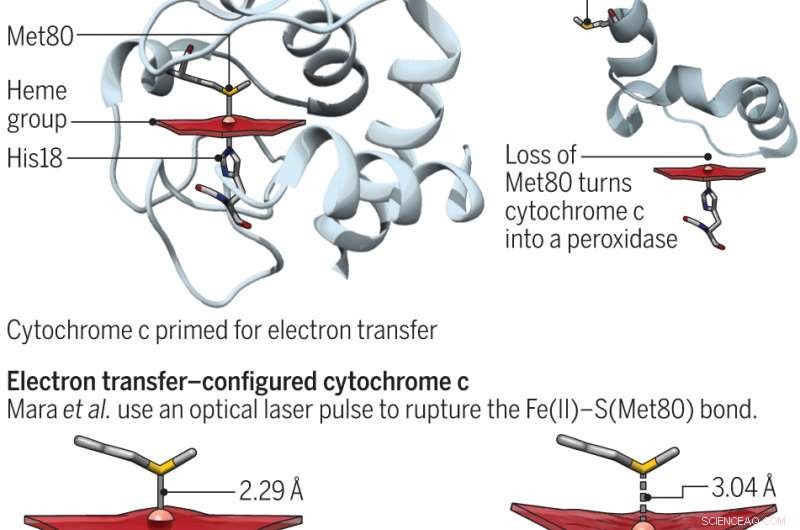
Un cambio en la conformación del sitio activo convierte al citocromo c de un transbordador de electrones en la respiración a una enzima peroxidasa para la apoptosis. Crédito:(c) Ciencias 23 de junio de 2017:Vol. 356, Edición 6344, págs. 1236, DOI:10.1126 / science.aan5587
(Phys.org) —Un equipo de investigadores de la Universidad de Stanford ha utilizado espectroscopía de emisión y absorción de rayos X ultrarrápida para cuantificar el estado entático del citocromo c. En su artículo publicado en la revista Ciencias , el grupo describe su procedimiento y lo que aprendieron. Kara Bren y Emma Raven, de la Universidad de Rochester y la Universidad de Leicester, respectivamente, ofrecen un artículo en perspectiva sobre el trabajo realizado por el equipo en el mismo número de la revista. y describa algunas de las implicaciones relacionadas con el papel que desempeña la proteína en la vida y muerte celular.
El citocromo c es una proteína que existe en muchas plantas, animales y organismos unicelulares. Inhumanos, sus propósitos principales son transportar electrones a las mitocondrias y ayudar con la apoptosis (muerte celular normal y los procesos que la rodean). Estas dos funciones se han demostrado en esfuerzos anteriores para depender de la posición del residuo de metionina. Cuando el azufre trabaja con el hierro, la proteína está lista para transferir electrones. De lo contrario, participa en actividades de peroxidasa. En este nuevo esfuerzo, los investigadores buscaron comprender mejor la energía de la proteína al sondear el enlace de hierro y azufre. Estados entáticos, Bren y Raven señalan, son muy importantes en la química bioinorgánica; en realidad, se traducen en algo que se estira cuando se somete a tensión.
Para comprender mejor el vínculo entre los dos elementos, los investigadores los separaron temporalmente utilizando un láser de electrones libres de rayos X de fuente de luz coherente Linac y luego midieron el tiempo que tardaron los dos componentes en reformarse utilizando espectroscopía de emisión de rayos X de hierro. Descubrieron que el entorno en el que vivían aumentaba la fuerza de unión en cuatro kilocalorías por mol, lo cual fue suficiente para permitir a la proteína alternar entre sus estados funcionales y cuantificar el costo energético del estado entático.
Como señalan Bren y Raven, los resultados del estudio tienen implicaciones con respecto al papel que juega el citocromo en la respiración, que relacionan con la vida y la apoptosis, que relacionan con la muerte. Para promover una vida continua, la proteína ayuda a mantener un cierto potencial de reducción. Para la apoptosis, el estado entático se altera, lo que permite potenciar la actividad de la peroxidasa.
© 2017 Phys.org