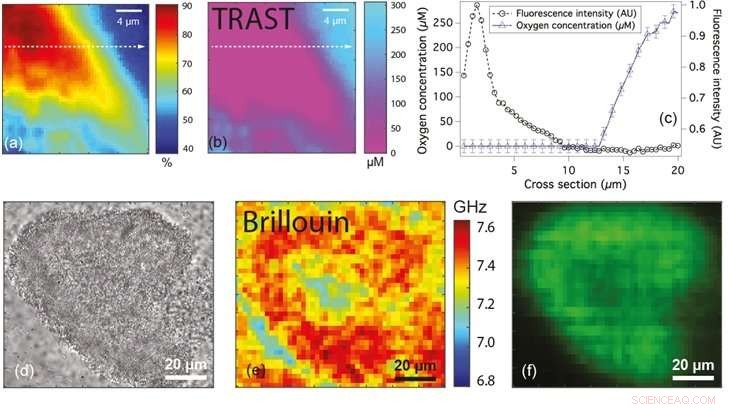
Las figuras (a) y (b) muestran el mapa de fluorescencia y concentración de oxígeno de una microcolonia de bacterias, respectivamente. La Figura (c) muestra el perfil de la línea de fluorescencia (círculos) y concentración de oxígeno (triángulos) a lo largo de la línea de puntos en (a) y (b). Figuras (d), (e) y (f) son microscópicos de campo amplio, Imágenes de brillo y fluorescencia, respectivamente, de una microcolonia de bacterias que muestran diferencias en el cambio de frecuencia, que se puede utilizar para clasificar el estado de la biopelícula. Crédito:Universidad Nacional de Singapur
Científicos de NUS, junto con investigadores de la Universidad Tecnológica de Nanyang (NTU) y el Imperial College London (ICL), han desarrollado técnicas biofísicas no invasivas para cuantificar la concentración de oxígeno y las propiedades micromecánicas en biopelículas bacterianas y comprender sus respuestas en tiempo real a los cambios ambientales.
Comunidades de bacterias, hongos Los protozoos o algas que se adhieren entre sí o superficies se conocen como biopelículas. Las biopelículas se caracterizan por una variedad de propiedades que no se encuentran típicamente en organismos aislados de vida libre. Una de las propiedades emergentes de las biopelículas relevantes en el contexto de la salud humana es su mayor tolerancia a los desinfectantes y antibióticos. Si bien algunas biopelículas son beneficiosas (por ejemplo, las que participan en el tratamiento de aguas residuales y la biorremediación), muchos otros son dañinos (por ejemplo, los implicados en infecciones y corrosión). Como ocurre con cualquier organismo vivo, las biopelículas se adaptan y responden continuamente a una variedad de tensiones ambientales, como cambios en la disponibilidad de nutrientes u oxígeno.
El oxígeno juega un papel fundamental en la generación de energía para el mantenimiento y crecimiento celular. Es necesario cuantificar la cantidad de oxígeno para estudiar sus efectos durante las distintas etapas del crecimiento de la biopelícula. Las herramientas actuales para medir los niveles de oxígeno en las biopelículas consumen oxígeno por sí mismas (lo que conduce a resultados menos precisos) o solo pueden obtener mediciones precisas de la superficie pero no dentro de las biopelículas.
Para superar estas limitaciones, Prof Thorsten WOHLAND de los Departamentos de Ciencias Biológicas y Química, NUS, junto con el profesor Yehuda COHEN y el profesor Scott RICE de NTU, han adaptado una técnica no invasiva llamada imágenes de estado transitorio (TRAST) y la han aplicado para cuantificar los niveles de oxígeno en las biopelículas bacterianas. Esto llevó a la identificación de zonas deficientes en oxígeno dentro de las colonias microscópicas de P. aeruginosa. TRAST es una técnica de obtención de imágenes basada en luminiscencia. Se basa en el hecho de que ciertos fluoróforos (un tipo de compuesto químico fluorescente) ocupan dos estados diferentes, uno que emite fluorescencia y el otro un estado oscuro no fluorescente. La fracción de fluoróforos en el estado oscuro depende de la frecuencia con la que se excitan los fluoróforos y si se les da suficiente tiempo para regresar de los estados oscuros a los estados fluorescentes. Al cambiar el esquema de iluminación de formas definidas, la cantidad de fluoróforos en la biopelícula (en estado oscuro) se puede medir fácilmente. Las mediciones dependen solo de la fracción de fluoróforos en el estado oscuro, lo que significa que la precisión no se ve afectada incluso si ciertas regiones de la biopelícula tienen una mayor concentración de fluoróforo. Dado que el oxígeno suprime la ocupación de estados oscuros, y así reduce los fluoróforos que residen en el estado oscuro, TRAST se puede utilizar para cuantificar las concentraciones de oxígeno.
Esta herramienta tiene implicaciones potenciales en microbiología para diferenciar las zonas ricas en oxígeno de las deficientes en oxígeno, que normalmente están ocupadas por bacterias aeróbicas y anaeróbicas, respectivamente, en una biopelícula de varias especies. Esta diferenciación es importante en el diagnóstico porque ayudará a identificar el tipo de bacteria en el sitio de la infección.
El mismo equipo de investigación, en colaboración con el profesor Peter TÖRÖK de ICL, también ha desarrollado una técnica que utiliza microscopía Brillouin para probar las propiedades mecánicas de las biopelículas a nivel de escala micrométrica. La microscopía Brillouin permite la cuantificación de la compresibilidad midiendo el cambio en la frecuencia de la luz incidente al interactuar con la biopelícula. La compresibilidad de un material es la cantidad de tensión necesaria para provocar un cambio en el volumen de un material. La compresibilidad de un material se puede interpretar en términos de la rigidez del material. Los materiales que exhiben cambios de frecuencia más grandes son más rígidos que aquellos con cambios de frecuencia más pequeños. Esta tecnica, que está "sin etiqueta" (es decir, no utiliza moléculas extrañas), potencialmente se puede utilizar para comprender las propiedades micromecánicas de biopelículas complejas.
El profesor Wohland dijo:"Las biopelículas pueden tener efectos destructivos, por ejemplo en la infección de heridas o en la degradación de materiales. Sin embargo, también se pueden aprovechar para la producción de materiales biológicos u otros procesos. Ambas aplicaciones necesitan un buen conocimiento de las propiedades físicas y fisiológicas de las biopelículas. Por lo tanto, nuevas herramientas, como nuestro equipo ha desarrollado, son necesarios para caracterizar mejor las biopelículas en su entorno natural ".