Los investigadores utilizan potentes rayos X para revelar las estructuras moleculares en el sitio donde los compuestos farmacológicos interactúan con los receptores celulares. Estas estructuras ayudan a señalar el camino para diseñar los medicamentos del futuro. Crédito:Greg Stewart / SLAC National Accelerator Laboratory
Los investigadores esperan diseñar una nueva generación de medicamentos contra una variedad de enfermedades mortales. La tarea, sin embargo, es costoso, arduo y, a menudo, ineficaz. Uno de los desafíos clave es comprender una clase particular de proteínas que adornan las superficies celulares, que son los objetivos de la mayoría de los fármacos.
Ahora Wei Liu y sus colegas del Biodesign Institute de ASU, junto con un equipo dirigido por Haitao Zhang y Vadim Cherezov de la USC han examinado un objetivo farmacológico prometedor con luminosos detalles, utilizando un dispositivo conocido como láser de electrones libres de rayos X, o XFEL.
Sus resultados, que aparecen en la edición avanzada en línea de la revista Naturaleza , arrojar nueva luz sobre AT2R, un receptor celular crítico, cuya gama de funciones los investigadores apenas han comenzado a desentrañar. Los hallazgos del grupo podrían acelerar el desarrollo de nuevos compuestos que abordan las afecciones cardiovasculares, dolor neuropático y crecimiento de tejidos.
AT2R pertenece a una familia de receptores celulares conocidos como GPCR (para receptor acoplado a proteína G), la familia más grande de receptores de membrana celular en el genoma humano. Como explica Liu, Los GPCR son candidatos tan atractivos para la selección de nuevos fármacos porque proporcionan líneas de comunicación esenciales entre el entorno externo de una célula y su funcionamiento interior.
"Los seres humanos tenemos más de 800 GPCR, "Dice Liu" y cada uno de ellos es importante, porque reconocen miles de entidades diferentes desde fuera de la célula, incluyendo moléculas pequeñas, péptidos proteínas e incluso fotones ". La rodopsina GPCR sensible a la luz, por ejemplo, es fundamental para la visión, Los receptores olfativos explican el sentido del olfato, mientras que la cafeína en el café actúa uniéndose a los receptores de adenosina, Etcétera.
Además de sus funciones vitales de limpieza, Los GPCR proporcionan dianas farmacológicas para el tratamiento de una gran variedad de enfermedades humanas. "Para casi cualquier enfermedad con la que estemos luchando, Las proteínas GPCR podrían ser los posibles objetivos farmacológicos:receptores de quimiocinas para el VIH, receptores de serotonina para la enfermedad de Alzheimer, receptores de dopamina para la adicción a las drogas y el Parkinson, "Dice Liu.

La estación experimental de imágenes de rayos X coherentes (CXI) del láser de rayos X de fuente de luz coherente Linac (LCLS) de SLAC está especialmente equipada para estudiar proteínas cristalizadas en detalle a escala atómica. Esta estación se utilizó en un estudio del receptor AT2 de angiotensina II unido a un compuesto farmacológico. Crédito:Laboratorio del Acelerador Nacional SLAC
Utilizando potentes rayos X de la fuente de luz coherente Linac (LCLS) de SLAC y la fuente de fotones avanzada (APS) del laboratorio nacional de Argonne, Los científicos descubrieron nuevos detalles estructurales del receptor de angiotensina II AT2R que han desconcertado a los investigadores durante dos décadas. AT2R es uno de los dos receptores de angiotensina II, y su pareja, AT1R, se ha utilizado con éxito como objetivo para medicamentos para la presión arterial alta.
La información revelada por el estudio podría brindar a los desarrolladores de medicamentos un nuevo camino para los compuestos que combaten el dolor y la inflamación o promueven la regeneración de tejidos al acoplarse cómodamente en un bolsillo en la elaborada forma tridimensional de AT2R.
"A diferencia de su hermano AT1R, el receptor AT2 no se ha entendido completamente, "dijo Cherezov, profesor de química en la Universidad del Sur de California e investigador principal del estudio. "A través de este estudio, descubrimos muchos detalles importantes sobre la estructura del receptor AT2 y cómo se une a los compuestos químicos, información que estimulará más estudios sobre la función del receptor y podría permitir un emocionante próximo paso en el descubrimiento de fármacos ".
Dos receptores, Muchos misterios
Ambos receptores de angiotensina II, AT1 y AT2, son componentes clave de un sistema hormonal que ayuda a regular la presión arterial y los niveles de sodio en la sangre. Se conocen como "proteínas de membrana" porque se encuentran a horcajadas sobre las membranas plasmáticas de las células, donde reciben señales de hormonas fuera de la célula y las transmiten a socios solubles dentro de la célula, como proteínas G o β-arrestinas, desencadenando una cascada de eventos que propagan la señal por toda la célula.
Muchos medicamentos para la hipertensión que se encuentran actualmente en el mercado se dirigen al receptor AT1 debido a su bien entendido papel en la regulación de la presión arterial; bloquean AT1 para reducir la presión arterial. El receptor AT2, por otra parte, sigue siendo un objetivo farmacológico esquivo a pesar de múltiples estudios sobre su función. Algunos, pero no todos, han demostrado que contrarresta los efectos de AT1; otros señalan su potencial para la protección y regeneración de tejidos; y otros sugieren que podría desempeñar un papel en el bloqueo del dolor.
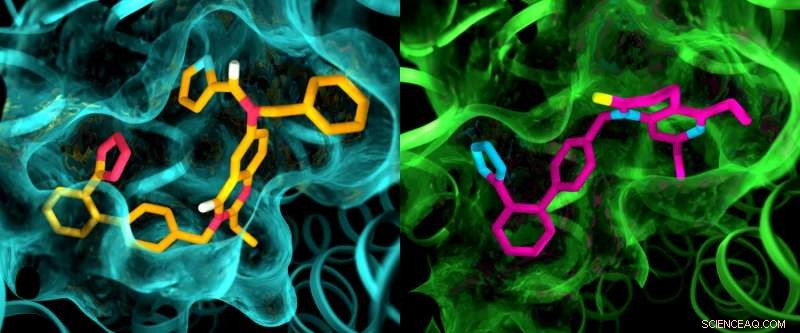
Aunque se cree que los dos receptores de angiotensina II son muy similares, un estudio de rayos X mostró claras diferencias en los bolsillos donde los receptores se unen a compuestos similares a fármacos. Esta ilustración muestra detalles en las estructuras de bolsillo de AT2 (izquierda) y AT1 (derecha). Crédito:Greg Stewart / SLAC National Accelerator Laboratory
Si bien aún no hay medicamentos aprobados que actúen sobre los receptores AT2, Las compañías farmacéuticas están buscando agresivamente compuestos que los activen o los bloqueen. Uno de esos compuestos, llamado EMA401, se está probando en pacientes para el tratamiento del dolor neuropático.
El último estudio aborda dos objetivos:comprender en qué se diferencia AT2 de AT1, para apuntarle selectivamente; y explorando por qué AT2, que tiene todas las características clásicas de un GPCR, al igual que AT1:no activa las proteínas G, que difunden señales dentro de las células, o interactuar con arrestina, apagando esas señales.
Biología bajo luz de rayos X
En los experimentos, los investigadores observaron dos tipos diferentes de muestras, que se formaron en cristales para examinarlos con rayos X. En uno, el receptor AT2 estaba unido a un compuesto selectivo, uno que se une solo a AT2. Estos cristales eran tan pequeños que solo podían estudiarse en el láser de rayos X de electrones libres LCLS de SLAC, donde fueron transmitidos a través de un haz de pulsos de rayos X ultrarrápidos.
En el otro, se unió un compuesto no selectivo tanto a AT1 como a AT2. Estas muestras, que formaron cristales más grandes, se sondearon en la fuente de luz de sincrotrón APS de Argonne.
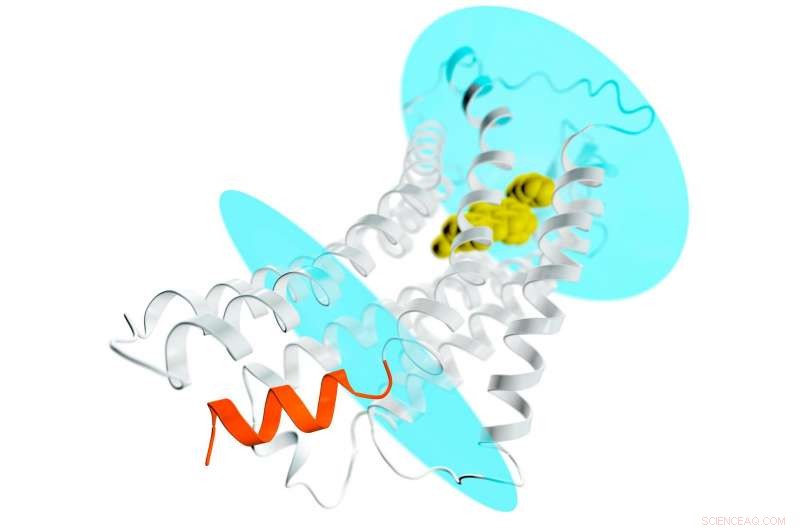
Una representación del receptor AT2 (espirales y filamentos grises) que se extiende a través de una membrana celular; los óvalos azules representan las superficies interna y externa de la membrana. Un compuesto farmacológico potencial se une al bolsillo exterior del receptor (amarillo) estabilizando el receptor en una conformación de tipo activo. Esto normalmente conduciría a la activación de proteínas G y a la difusión de una señal por toda la célula. Pero en el caso de AT2, el lugar donde se acoplan las proteínas G para recibir la señal está bloqueado por una hélice en forma de espiral (naranja) que forma parte del receptor. Este nuevo detalle ayuda a explicar por qué los receptores AT2 no se unen ni activan las proteínas G, pero en cambio probablemente transmita la señal dentro de la célula a través de otros mecanismos aún desconocidos. Crédito:Greg Stewart / SLAC National Accelerator Laboratory
Resultados inesperados
Los resultados de los experimentos fueron sorprendentes en varios sentidos. Primero, aunque ambos compuestos fueron diseñados para bloquear y desactivar los receptores, dejaron AT2 en un estado que parecía estar activo. Además, aunque se pensaba que AT1 y AT2 eran muy similares, los bolsillos donde los receptores se unen a los compuestos exhibieron marcadas diferencias.
"Esto es algo que nunca hemos visto con los GPCR, ", Dijo Cherezov." La idea siempre fue que los receptores que se unen a los mismos compuestos tendrían bolsas muy similares, por lo que los esfuerzos para desarrollar fármacos que actúan sobre AT2 comenzaron con las mismas estructuras básicas que los fármacos que actúan sobre AT1. Ahora vemos que es posible que tengamos que comenzar con moléculas similares a fármacos completamente diferentes que están diseñadas para adaptarse al receptor AT2, lo que podría orientar el proceso de descubrimiento de fármacos en una dirección diferente ".
Los participantes de la ASU ayudaron con el análisis de datos, así como con la preparación y caracterización de muestras. Liu, anteriormente miembro del equipo de USC, también ayudó con el diseño de la construcción del receptor, purificación y cristalización.
Liu enfatiza que muchas proteínas GPCR importantes adecuadas para dianas farmacológicas solo pueden formar cristales muy pequeños (de menos de 100 micrones de longitud) en el laboratorio. Históricamente, la capacidad de cultivar grandes cristales de proteínas en el laboratorio era un requisito previo para estudiar su estructura 3D a altas resoluciones, ya que los cristales más pequeños serían destruidos por la radiación de sincrotrón. Ahora sin embargo, el estudio de estas moléculas se ha revolucionado mediante el uso de la tecnología XFEL, lo que expone los cristales de tamaño micrométrico a ráfagas de radiación tan breves que permanecen intactos.
ASU es pionera en este nuevo dominio de estudio, combinando su experiencia en la producción de pequeños cristales adecuados para el análisis de proteínas GPCR con la capacidad de obtener imágenes de tales muestras a una resolución extremadamente alta utilizando XFEL.
El Biodesign Institute ha emprendido recientemente un audaz proyecto para construir un XFEL compacto, el primero de su tipo, capaz de realizar este tipo de análisis estructural de proteínas de alta resolución, reduciendo radicalmente los costes y mejorando la accesibilidad. (En la actualidad, solo existen 3 grandes máquinas XFEL, las instalaciones de SLAC en Stanford, DESY en Hamburgo, Alemania y la SACLA XFEL, en Harima, Japón.)
"XFEL abre la puerta a todos estos objetivos de proteínas de membrana, "Liu dice, enfatizando que el campo de la cristalografía de rayos X está ahora preparado para un rápido avance.