Investigadores dirigidos por el Prof. Zhang Zairong del Instituto de Química Orgánica de Shanghai de la Academia de Ciencias de China han identificado una vía de topogénesis postraduccional para el plegamiento y ensamblaje de proteínas de membrana de múltiples extensiones (MSP).
De las aproximadamente 5000 proteínas de membrana sintetizadas en la membrana del retículo endoplásmico (RE) de las células humanas, más de la mitad son MSP que desempeñan funciones críticas en la fisiología celular y del organismo, funcionando como canales iónicos, transportadores, receptores y enzimas intramembrana.
Una proporción significativa de estas funciones depende de aminoácidos polares y cargados, lo que lleva a la formación de TMD poco hidrofóbicos (pTMD). Sin embargo, los pTMD enfrentan desafíos para ser reconocidos e integrados en la bicapa de fosfolípidos por el translocón Sec61, que prefiere los TMD hidrofóbicos.
En el proteoma humano, aproximadamente el 30% de las proteínas de membrana y más del 50% de las MSP contienen al menos un pTMD. Cómo se identifican eficazmente estos pTMD y se empaquetan con precisión en estructuras MSP maduras ha sido una cuestión científica importante.
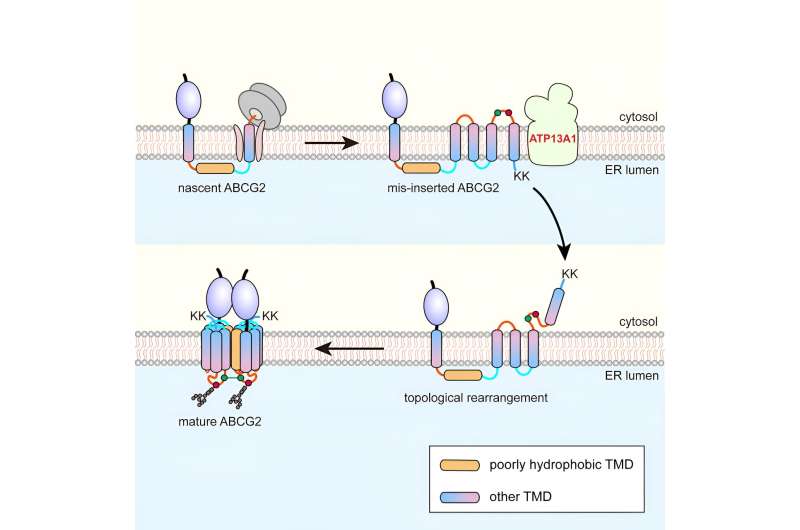
Utilizando el transportador de casete de unión a trifosfato de adenosina G2 (ABCG2) de seis proteínas como modelo, los investigadores descubrieron que durante la translocación cotraduccional, el pTMD2 de ABCG2 pasa a través del poro central del translocón hacia la luz del RE, en lugar de integrarse en la bicapa de fosfolípidos a través de la puerta lateral del translocón.
Esto da como resultado la inserción de TMD aguas abajo en la membrana del ER con orientaciones inversas, formando así un intermedio único. Tras la traducción de los residuos de lisina gemelos C-terminales cargados positivamente, se produce un proceso de reordenamiento topológico casi global.
La purificación por afinidad mostró que ATP13A1 puede detectar la señal de carga positiva C-terminal de ABCG2. La sustitución de residuos de lisina con aminoácidos neutros o cargados negativamente atenúa significativamente las interacciones entre los mutantes ATP13A1 y ABCG2.
Además, la eliminación de ATP13A1 resultó en la aparente acumulación de conformaciones ABCG2 mal plegadas, principalmente aquellas con TMD6 mal orientado dentro de la membrana del RE. Por lo tanto, ATP13A1 desempeña un papel crucial en la topogénesis de las MSP, donde su actividad ATPasa promueve la dislocación del TMD6 mal orientado desde la bicapa lipídica hacia el citosol.
Posteriormente, el TMD6 citosólico se reintegra en la membrana del RE, impulsando así el reordenamiento topológico postraduccional de otros TMD aguas arriba.
Tras una reordenación exitosa de los TMD 4-6, el intermedio puede oligomerizarse en una estructura cuaternaria. Es probable que este proceso facilite la integración de pTMD2 en la estructura final de la luz acuosa del RE y en la estructura madura, que está estrechamente envuelta por los TMD circundantes.
En resumen, el estudio, ahora publicado en Molecular Cell , explica cómo un pTMD "difícil" se omite cotraduccionalmente para su inserción y se entierra postraduccionalmente en la estructura final correcta en la última etapa de plegado, evitando así la exposición excesiva a los lípidos.
En particular, debido a la exposición de pTMD2 a la luz del RE durante la topogénesis ABCG2, la modificación de la glicosilación N441 causada por la mutación genética ABCG2-S441N puede bloquear significativamente el ensamblaje de pTMD en la etapa tardía de la topogénesis. Como ABCG2 es un transportador de ácido úrico, este estudio explica cómo esta mutación está estrechamente asociada con enfermedades humanas como la gota y la hiperuricemia.
Más información: Jia Ji et al, Una vía de topogénesis asistida por ATP13A1 para plegar proteínas de membrana de múltiples extensiones, Molecular Cell (2024). DOI:10.1016/j.molcel.2024.04.010
Información de la revista: Célula molecular
Proporcionado por la Academia China de Ciencias