Científicos del Laboratorio Nacional Brookhaven del Departamento de Energía de EE. UU. (DOE) han descubierto que una proteína responsable de la síntesis de un material vegetal clave evolucionó mucho antes de lo que se sospechaba. La investigación publicada en The Plant Cell , explora el origen y la evolución de la maquinaria bioquímica que produce lignina, un componente estructural de las paredes celulares de las plantas con impactos significativos en la industria de la energía limpia.
Cuando las primeras plantas terrestres surgieron de ambientes acuáticos, necesitaron adaptarse para sobrevivir.
Chang-Jun Liu, científico principal del Departamento de Biología de Brookhaven, dijo:"La aparición de la lignina, que proporciona soporte estructural a las plantas, fue un evento evolutivo clave que permitió la supervivencia de las plantas en el nuevo entorno terrestre".
Comprender cómo las plantas desarrollaron mecanismos de protección que les permiten sobrevivir en nuevos entornos es vital a medida que enfrentan los desafíos impuestos por el cambio climático actual. Pero la lignina también es de gran interés para los investigadores que buscan opciones de energía limpia.
Este resistente material vegetal puede procesarse y convertirse en valiosos bioproductos. Y la lignina es la única fuente renovable de compuestos aromáticos, que son químicamente similares a las moléculas que se encuentran en el combustible para aviones convencional y que las aerolíneas pueden utilizar como combustible "directo".
"Las plantas modernas contienen tres tipos de lignina, pero la mayoría de las primeras plantas que contenían lignina sólo tenían dos tipos. La lignina 'más nueva' se llama siringil-lignina o S-lignina", explicó Liu. La S-lignina evolucionó relativamente recientemente en las plantas con flores y es estructuralmente menos compleja que los otros componentes de la lignina. Sus posibles aplicaciones industriales, en particular, han captado la atención de los científicos porque la S-lignina es relativamente fácil de descomponer en compuestos aromáticos simples.
El nuevo estudio se basa en años de investigación centrada en la lignina y las moléculas responsables de su síntesis. En 2019, Liu y sus colegas descubrieron que una proteína específica del citocromo b5, CB5D, es indispensable para la producción de S-lignina, pero no de otros tipos de lignina más antiguos.
"La singularidad del papel del CB5D en la síntesis de S-lignina nos intrigó", señaló Liu. "Por eso nos inspiramos a explorar más a fondo su origen y evolución".
En un estudio anterior, el equipo de Liu descubrió que CB5D tiene una asociación especial con una enzima llamada ferulado 5-hidroxilasa (F5H). Juntas, estas moléculas sintetizaron la valiosa S-lignina.
Los científicos sabían que la evolución del F5H en las plantas con flores había conducido a la producción de S-lignina. Por lo tanto, esperaban descubrir que CB5D había coevolucionado con F5H.

Para explorar su hipótesis, los científicos realizaron un análisis genético para encontrar otras especies de plantas cuyo ADN contenía genes similares al gen CB5D moderno, que actúa como instrucciones para ensamblar la proteína CB5D. Identificaron 21 especies, desde evolutivamente antiguas hasta evolutivamente recientes. Luego, los científicos sintetizaron estos genes y los expresaron individualmente en una especie de planta moderna que fue modificada genéticamente para carecer del gen CB5D.
"Sin el gen CB5D, la planta sintetiza sólo una pequeña cantidad de S-lignina", dijo Xianhai Zhao, investigador postdoctoral en Brookhaven y autor principal del nuevo artículo. "Pero si esta función se restableciera con la expresión de uno de los genes relacionados, entonces sabríamos que ese gen funciona de manera similar al gen CB5D moderno".
Los científicos descubrieron que un gen de una especie de alga verde que evolucionó hasta convertirse en una planta terrestre primitiva hace más de 500 millones de años restableció la síntesis de S-lignina en la planta moderna. Esto indicó que el gen exhibía una funcionalidad de tipo CB5D. Los científicos también descubrieron que la función se conservaba en varias plantas terrestres primitivas, como las hepáticas y los musgos.
"Esto significa que el CB5D evolucionó millones de años antes de lo que esperábamos", explicó Liu. "Fue bastante sorprendente descubrir que un aceptor de electrones moderno como el F5H se había asociado con una proteína antigua para desarrollar una nueva maquinaria bioquímica que sintetiza la estructura avanzada de la lignina".
El gen CB5D y su homólogo más antiguo contenían secuencias y funciones de ADN similares. Pero los científicos querían asegurarse de que la proteína CB5D de una especie antigua, como la hepática, se expresara en las mismas estructuras subcelulares que la CB5D moderna.
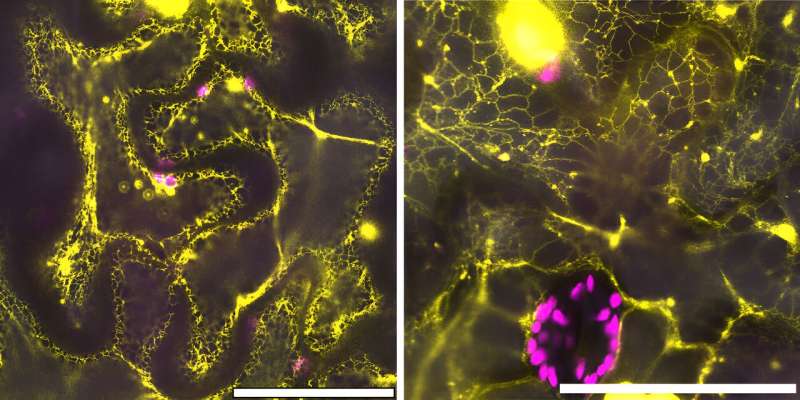
Entonces, utilizaron microscopía confocal en el Centro de Nanomateriales Funcionales, una instalación para usuarios de la Oficina de Ciencias del DOE en Brookhaven Lab, para confirmar que este era el caso.
Habiendo encontrado genes antiguos que codifican proteínas similares a la proteína CB5D moderna en términos de síntesis de S-lignina en plantas modernas y localización celular, el equipo quería aprender más sobre la antigua función de esta proteína y cómo cambiaba o se expandía con el tiempo.
Su análisis mostró que la proteína similar a CB5D surgió en algas acuáticas justo antes de que hicieran la transición a un ambiente terrestre. Y debido a que se conservó en las primeras plantas terrestres, esta proteína probablemente cumple una o más funciones esenciales.
"Las plantas antiguas como la hepática no contenían S-lignina", dijo Zhao. "Si la proteína tipo CB5D no fue responsable de sintetizar S-lignina, ¿qué hizo?"
Liu comentó:"Esa es la belleza de la investigación. Responder una pregunta te lleva a preguntas aún más interesantes que esperan ser exploradas".
Más información: Xianhai Zhao et al, La diversidad del citocromo b5 en linajes verdes precedió a la evolución de la biosíntesis de siringil lignina, La célula vegetal (2024). DOI:10.1093/plcell/koae120
Información de la revista: Célula vegetal
Proporcionado por el Laboratorio Nacional Brookhaven