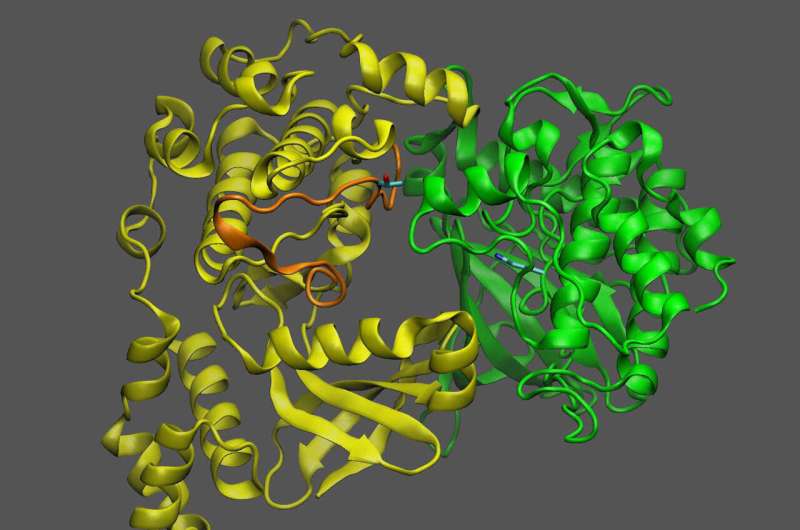
Las proteínas son máquinas moleculares, con piezas flexibles y partes móviles. Comprender cómo se mueven estas partes ayuda a los científicos a desentrañar la función que desempeña una proteína en los seres vivos y, potencialmente, cómo cambiar sus efectos. Bioquímicos del Laboratorio Nacional Brookhaven del Departamento de Energía de EE. UU. (DOE) y colegas del Laboratorio Nacional del Noroeste del Pacífico (PNNL) del DOE han publicado un nuevo ejemplo de cómo funciona una de esas máquinas moleculares.
Su artículo en la revista Science Advances describe cómo las partes móviles de una proteína vegetal en particular controlan si las plantas pueden crecer y producir productos que consumen mucha energía, como el petróleo, o, en cambio, implementar una serie de pasos para conservar recursos preciosos. El estudio se centra específicamente en cómo la maquinaria molecular está regulada por una molécula que sube y baja con el nivel de azúcar, la principal fuente de energía de las plantas.
"Este artículo revela el mecanismo detallado que le dice a las células vegetales 'tenemos mucha azúcar', y luego cómo esa señalización afecta las vías bioquímicas que desencadenan procesos como el crecimiento de las plantas y la producción de petróleo", dijo la bioquímica del Brookhaven Lab Jantana Blanford, líder del estudio. autor.
El estudio se basa en trabajos anteriores del equipo de Brookhaven que descubrieron vínculos moleculares entre los niveles de azúcar y la producción de petróleo en las plantas. Un objetivo potencial de esta investigación es identificar proteínas específicas (y partes de proteínas) que los científicos puedan diseñar para producir plantas que produzcan más aceite para su uso como biocombustibles u otros productos a base de petróleo.
"Identificar exactamente cómo interactúan estas moléculas y proteínas, como lo hace este nuevo estudio, nos acerca a identificar cómo podríamos diseñar estas proteínas para aumentar la producción de aceite vegetal", dijo John Shanklin, presidente del Departamento de Biología del Brookhaven Lab y líder del equipo de investigación. .
El equipo utilizó una combinación de experimentos de laboratorio y modelos computacionales para concentrarse en cómo la molécula que sirve como sustituto del azúcar se une a un "sensor quinasa" conocido como KIN10.
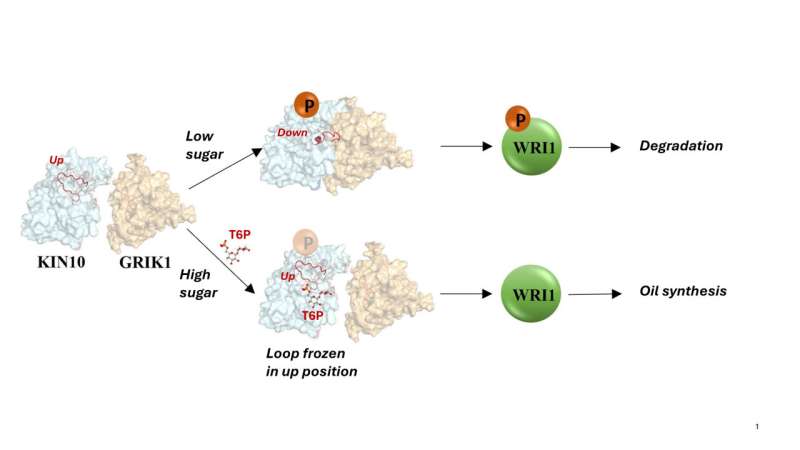
KIN10 es la proteína que contiene las partes móviles que determinan qué vías bioquímicas están activadas o desactivadas. Los científicos ya sabían que KIN10 actúa como un sensor y un interruptor de azúcar:cuando los niveles de azúcar son bajos, KIN10 interactúa con otra proteína para desencadenar una cascada de reacciones que finalmente detienen la producción de petróleo y descomponen moléculas ricas en energía como el petróleo y almidón para producir energía que alimenta la célula.
Pero cuando los niveles de azúcar son altos, la función de apagado de KIN10 se desactiva, lo que significa que las plantas pueden crecer y producir mucho aceite y otros productos con abundante energía.
Pero, ¿cómo activa el interruptor el proxy de azúcar que se une a KIN10?
Para descubrirlo, Blanford empezó con el dicho de "los opuestos se atraen". Identificó tres partes cargadas positivamente de KIN10 que podrían ser atraídas por abundantes cargas negativas en la molécula representante del azúcar. Un proceso de eliminación realizado en laboratorio que implicó realizar variaciones de KIN10 con modificaciones en estos sitios identificó el único sitio de unión verdadero.
Luego, el equipo de Brookhaven recurrió a colegas computacionales de PNNL.
Marcel Baer y Simone Raugei de PNNL examinaron a nivel atómico cómo encajan el proxy del azúcar y KIN10.
"Al utilizar modelos multiescala, observamos que la proteína puede existir en múltiples conformaciones, pero sólo una de ellas puede unirse eficazmente al sustituto del azúcar", dijo Baer.
Las simulaciones de PNNL identificaron aminoácidos clave dentro de la proteína que controlan la unión del azúcar. Estos conocimientos computacionales se confirmaron experimentalmente.
El conjunto combinado de información experimental y computacional ayudó a los científicos a comprender cómo la interacción con el sustituto del azúcar afecta directamente la acción posterior de KIN10.
"Análisis adicionales mostraron que toda la molécula KIN10 es rígida excepto por un bucle largo y flexible", dijo Shanklin. Los modelos también demostraron que la flexibilidad del bucle es lo que permite que KIN10 interactúe con una proteína activadora para desencadenar la cascada de reacciones que finalmente detiene la producción de petróleo y el crecimiento de las plantas.
Cuando los niveles de azúcar son bajos y hay poca molécula de azúcar presente, el circuito permanece flexible y el mecanismo de cierre puede operar para reducir el crecimiento de las plantas y la producción de aceite. Tiene sentido conservar recursos preciosos, afirmó Shanklin.
Más información: Jantana Blanford et al, Mecanismo molecular de la inhibición de la trehalosa 6-fosfato de la quinasa sensora metabólica vegetal SnRK1, Avances científicos (2024). DOI:10.1126/sciadv.adn0895. www.science.org/doi/10.1126/sciadv.adn0895
Información de la revista: Avances científicos
Proporcionado por el Laboratorio Nacional Brookhaven