
La comunicación eficiente entre las células es vital para muchos procesos biológicos, como el reclutamiento de células inmunes para combatir enfermedades. La rápida liberación de al menos 80 moléculas de señalización, incluido el factor de necrosis tumoral y el factor de crecimiento epidérmico, está controlada por una proteasa unida a la membrana llamada ADAM17.
Este proceso implica que ADAM17 escinda (desprenda) las moléculas de señalización de sus formas precursoras en la membrana de una célula. La "pseudoproteasa" iRhom2 ayuda en la maduración y transporte de ADAM17. Sin embargo, la falta de conocimiento estructural no ha dejado claros los mecanismos subyacentes a este proceso.
Publicado hoy en Molecular Cell , científicos del St. Jude Children's Research Hospital y la Universidad de Oxford han utilizado microscopía crioelectrónica para revelar una serie de estructuras del complejo humano ADAM17/iRhom2 tanto en estado activo como inactivo. Estas estructuras muestran que iRhom2 actúa como guardián del ciclo de vida de ADAM17, interactuando con regiones clave de ADAM17 que controlan su actividad.
El trabajo también ofrece vías potenciales para el diseño de fármacos destinados a combatir enfermedades de inflamación crónica y desregulación autoinmune. "Creemos que existe la posibilidad de diseñar moléculas pequeñas que se dirijan directamente a iRhom2 en lugar de a ADAM17, o a la interfaz entre iRhom2 y ADAM17", dijo la coautora correspondiente, Chia-Hsueh Lee, Ph.D., Departamento de Biología Estructural de St. Jude .
iRhom2 es una pseudoproteasa:tiene todas las características estructurales de una proteasa de la familia romboide, excepto que carece de la capacidad que define la proteasa para escindir proteínas. Sin embargo, como un perro viejo que aprende nuevos trucos, iRhom2 desempeña funciones nuevas en el andamiaje y el transporte de ADAM17.
Como revelaron los estudios estructurales, el impacto de iRhom2 en la función ADAM17 comienza durante la síntesis inicial de las dos proteínas. "El retículo endoplásmico es donde se producen ADAM17 e iRhom2 y, en esta etapa, forman un complejo", explicó Lee. Luego, iRhom2 facilita el traslado de ADAM17 al aparato de Golgi para su maduración, donde las estructuras de Lee pusieron a prueba el concepto anterior de que iRhom2 sirviera simplemente como un "andamiaje pasivo".
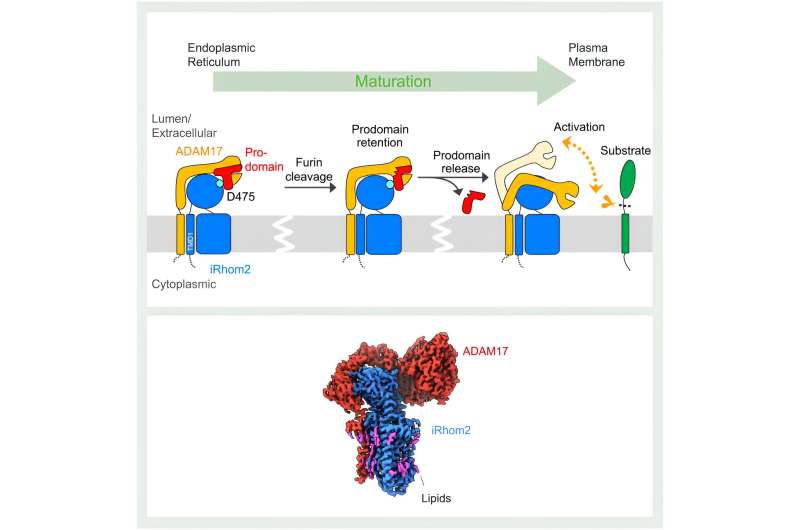
Se suponía que la interacción entre iRhom2 y ADAM17 se producía exclusivamente entre los dominios transmembrana de las proteínas, que fijan las proteínas a la membrana celular. Para sorpresa de los investigadores, las dos proteínas también interactúan a través de sus regiones extracelulares. A través de esas interacciones, iRhom2 se aferra a una región importante de ADAM17 llamada prodominio. El prodominio es una región que actúa como un imperdible en un extintor de incendios.
"El propio ADAM17 se autoinhibe. Tiene un límite de prodominio para bloquear su propio sitio de proteasa", explicó Lee.
Dentro del aparato de Golgi, esta capa de prodominio autorreguladora se escinde. Sin embargo, iRhom2 retiene la tapa de ADAM17 hasta que el complejo alcanza la membrana celular. Este paso es crucial para prevenir la activación prematura de ADAM17. Las nuevas estructuras revelan que una vez que se retira la tapa, ADAM17 se activa. Esta activación está marcada por una ganancia significativa en flexibilidad, lo que permite a ADAM17 buscar sustratos en el espacio circundante.
Se ha demostrado que ADAM17 desempeña un papel en el desarrollo y la progresión de múltiples tipos de cáncer; sin embargo, la familia de proteínas ADAM está bien conservada. Un fármaco que se dirige a ADAM17 puede provocar efectos no deseados. Lee es optimista en cuanto a que las estructuras pueden ofrecer un modelo para el ingenio del diseño de fármacos.
"Según nuestro modelo, si pudiéramos mantener juntas estas dos proteínas, por ejemplo, a través de un aglutinante que mejore la interacción entre iRhom2 y ADAM17, entonces iRhom2 no liberará la tapa del prodominio", dijo Lee. "Esto reducirá significativamente la actividad de ADAM17."
Los primeros autores del estudio son Fangfang Lu, de la Universidad de Oxford, y Hongtu Zhao, de St. Jude. Los otros coautores del estudio son Hongtu Zhao, St. Jude y Matthew Freeman, de la Universidad de Oxford. Los autores adicionales del estudio son Yaxin Dai y Yingdi Wang, St. Jude.
Más información: Fangfang Lu et al, Cryo-EM revela que iRhom2 restringe la actividad de la proteasa ADAM17 para controlar la liberación del factor de crecimiento y las señales inflamatorias, Molecular Cell (2024). DOI:10.1016/j.molcel.2024.04.025
Información de la revista: Célula molecular
Proporcionado por St. Jude Children's Research Hospital