Gráficamente abstracto. Crédito:Celular (2022). DOI:10.1016/j.cell.2022.04.023
El desarrollo temprano es como una danza cuidadosamente coreografiada, con franjas uniformes de células que se organizan en patrones elaborados, un primer paso hacia la formación de órganos funcionales. Una capa plana de células de la piel, por ejemplo, debe convertirse en una salpicada de ordenadas matrices de células ciliadas y glándulas sudoríparas.
Un nuevo estudio del Laboratorio de Morfogénesis de la Universidad Rockefeller, codirigido por Amy Shyer y Alan Rodrigues, revela que los patrones de desarrollo pueden surgir espontáneamente de las interacciones físicas entre los colectivos celulares y la matriz que los rodea. Tales interacciones generan propiedades similares a las de los fluidos que permiten la formación de patrones análogos a cómo una película de agua en el parabrisas se retrae en gotas.
Usando la piel de pollo como sistema modelo, los investigadores encontraron que las fuerzas mecánicas entre las células rompen la simetría del tejido, empujando a las células a agregarse en paquetes espaciados periódicamente que luego crecerán plumas en todo el tejido de la piel. Estos cambios estructurales desencadenan cambios secundarios en la expresión de genes que conducen a la señalización molecular clásica, lo que impulsa el desarrollo más adelante.
Los hallazgos, publicados en Cell , proporcionan una mejor comprensión de los factores físicos que intervienen en la formación de los órganos.
"El desarrollo de órganos implica una colaboración continua entre los procesos mecánicos y moleculares", dice la profesora asistente Amy Shyer. "Comprender la secuencia precisa de los pasos en ese ciclo de retroalimentación podría ayudarnos a reparar tejidos o estudiar la formación de tumores desde nuevos ángulos".
Estructuras ascendentes
Cuando emergen nuevos órganos del tejido embrionario homogéneo, parecen tomar la estructura óptima entre muchas posibilidades. "Una de las cosas misteriosas de estas estructuras es que tienen un patrón perfecto incorporado que realmente maximiza la eficiencia de su función", dice Shyer.
Históricamente, los genes obtuvieron gran parte del crédito por esta proeza de la ingeniería biológica. Son nuestros genes, se pensaba, los que proporcionan un modelo molecular que determina cómo las células se especializan en componentes específicos de órganos y cómo se reordenan para dar lugar a estructuras intrincadas. Pero algunos científicos han encontrado razones para cuestionar esa teoría. Por ejemplo, algunas estructuras se forman a una escala tan grande que es difícil explicar cómo las señales moleculares supervisan la formación de patrones en un rango tan largo, lo que sugiere que deben estar en juego otros mecanismos.
Desde una perspectiva alternativa, Shyer y Rodrigues se centran en el papel de la mecánica celular colectiva en la morfogénesis. Su trabajo anterior ha demostrado que los cambios morfológicos en la piel de las aves aparecen antes de que se expresen los genes implicados en la formación de folículos. "Así que no son necesariamente los genes los que inician los primeros cambios morfológicos", dice Rodrigues. "En cambio, descubrimos que las células se autoorganizan para iniciar folículos. Al mismo tiempo, no conocíamos el mecanismo preciso que permite esta autoorganización".
Alineación colectiva
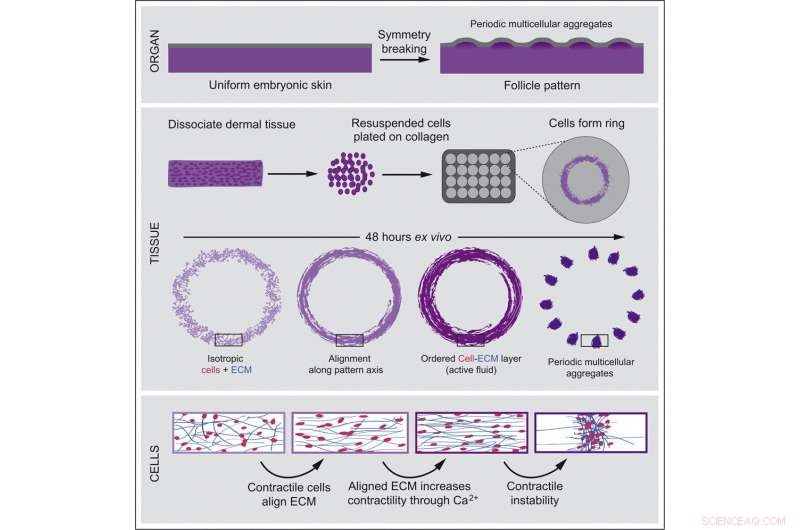
En el nuevo estudio, el equipo de Shyer y Rodrigues se dispuso a observar más de cerca qué es exactamente lo que impulsa el cambio del tejido. Para ampliar los momentos previos a la formación de patrones, los investigadores utilizaron células primarias de la piel recién extraídas de embriones de pollo y agregaron colágeno, un componente esencial que proporciona estructura a la piel. Solo estos dos ingredientes fueron suficientes para que todo el proceso se desarrollara en un plato de laboratorio. Este sistema permitió a los investigadores reconstruir el desarrollo natural de la piel mientras eliminaba cualquier señal molecular potencial de los tejidos vecinos.
Al observar el proceso de agregación celular cuadro por cuadro, Karl Palmquist, autor principal del estudio, descubrió que las células contráctiles de la piel comenzaron a adherirse al sustrato a base de colágeno similar a una malla que las rodeaba y a tirar de él. Luego hizo una observación clave:la fuerza de atracción de muchas células realinea la matriz en una estructura altamente ordenada que resiste la atracción. Las células, al sentir el aumento de la tensión, se contraen cada vez más, aumentando su fuerza de atracción. Finalmente, las fuerzas recíprocas entre las células y la matriz extracelular generan una alineación colectiva de las células que permite que el campo de células se transforme en un patrón ordenado de agregados similares a folículos.
Junto con Anna Erzberger, autora principal que realizó un posdoctorado en el laboratorio de James A. Hudspeth y actualmente es líder de grupo en el Laboratorio Europeo de Biología Molecular en Heidelberg, Alemania, el equipo desarrolló un modelo teórico de piel en desarrollo basado en la Propiedades físicas de los fluidos. Este modelo predijo con precisión la formación espontánea de agregados multicelulares regulares.
El equipo planea investigar cómo la mecánica multicelular similar puede ser integral en la estructuración de otros tejidos del cuerpo en desarrollo y enfermedad.