Gráficamente abstracto. Crédito:DOI:10.1021/acsnano.1c04496
El aumento de las infecciones por bacterias resistentes a los medicamentos es uno de los problemas de salud global más graves del mundo, y se estima que causará 10 millones de muertes al año para el año 2050. Algunos de los patógenos bacterianos más virulentos y resistentes a los antibióticos son la principal causa de enfermedades potencialmente mortales. , infecciones adquiridas en el hospital, particularmente peligrosas para pacientes inmunocomprometidos y en estado crítico. La síntesis tradicional y continua de antibióticos simplemente no podrá seguir el ritmo de la evolución de las bacterias.
Para evitar el proceso continuo de sintetizar nuevos antibióticos para atacar las bacterias a medida que evolucionan, los ingenieros de Penn han buscado un nuevo recurso natural para las moléculas de antibióticos.
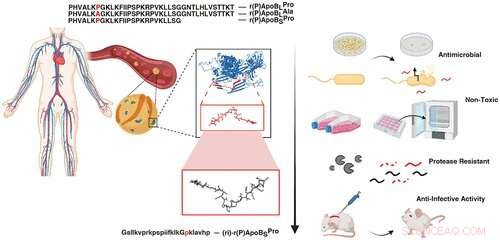
Un estudio reciente sobre la búsqueda de péptidos encriptados con propiedades antimicrobianas en el proteoma humano ha localizado antibióticos naturales dentro de nuestros propios cuerpos. Mediante el uso de un algoritmo para identificar secuencias específicas en nuestro código de proteínas, un equipo de investigadores de Penn junto con colaboradores, dirigidos por César de la Fuente, Profesor Asistente Presidencial en Psiquiatría, Bioingeniería, Microbiología e Ingeniería Química y Biomolecular, y Marcelo Torres, un postdoctorado en el laboratorio de de la Fuente, fueron capaces de localizar nuevos péptidos, o cadenas de aminoácidos, que cuando se escindieron, indicaron su potencial para defenderse de las bacterias dañinas.
Ahora, en un nuevo estudio publicado en ACS Nano , el equipo junto con Angela Cesaro, autora principal y postdoctoral en el laboratorio de de la Fuente, han identificado tres péptidos antimicrobianos distintos derivados de una proteína en plasma humano y demuestran sus habilidades en modelos de ratón. Ángela Cesaro realizó gran parte de las actividades durante su doctorado. bajo la supervisión de la autora correspondiente, la profesora Angela Arciello, de la Universidad de Nápoles Federico II. El estudio colaborativo también incluye a la Universidad de Utrecht en los Países Bajos.
"Identificamos el sistema cardiovascular como un punto caliente para los antimicrobianos potenciales utilizando un enfoque algorítmico", dice de la Fuente. "Luego observamos más de cerca una proteína específica en el plasma".
La apolipoproteína B es una proteína del plasma sanguíneo que transporta lípidos, como el colesterol, por todo el cuerpo. Sin embargo, cuando esta proteína se descompone, sus componentes peptídicos exhiben funciones completamente diferentes.
Utilizando su algoritmo, el equipo aisló tres péptidos de la apolipoproteína B y probó su capacidad para defenderse de diferentes tipos de bacterias, incluidas las que causan infecciones por estafilococos y neumonía.
Cada uno de los tres péptidos pudo penetrar la membrana citoplásmica de la bacteria, matar la célula e impedir el crecimiento de biopelículas. Además, cuando se usan en conjunto o con antibióticos farmacéuticos, su efecto antibiótico aumenta significativamente, lo que requiere una dosis más pequeña para combatir la infección.
El equipo también evaluó si estos péptidos promueven la resistencia a los antibióticos en estas bacterias.
"Hay muchas formas en que nuestras células inmunitarias y péptidos antimicrobianos atacan y combaten las infecciones bacterianas", dice de la Fuente. "Lo que es único en los péptidos que estamos examinando es su capacidad para atacar la membrana bacteriana, una estructura que requiere múltiples genes para construirse y mantenerse. Los antibióticos típicos solo se dirigen a un gen o aspecto de las células bacterianas, lo que hace que sea relativamente fácil para las bacterias desarrollar resistencia". , por lo que los antimicrobianos como los péptidos que describimos aquí que atacan múltiples objetivos a la vez tienen más éxito para impedir la resistencia bacteriana".
“En el experimento de evolución de la resistencia que realizamos en nuestro laboratorio, fue sorprendente ver la rapidez con la que se seleccionan nuevas bacterias resistentes a los antibióticos comunes y, por el contrario, cómo los péptidos encriptados descubiertos dentro del plasma no conducen a este tipo de selección. , dice Cesaro. "Este comportamiento podría derivar de un mecanismo de defensa del huésped desarrollado en humanos y conservado evolutivamente a lo largo del tiempo. Este trabajo abre nuevas vías para el descubrimiento de antimicrobianos en proteínas no relacionadas con el sistema inmunológico y esto es muy emocionante ya que en la actualidad se necesitan con urgencia nuevos antibióticos. ."
De hecho, son las propiedades fisicoquímicas de la propia membrana bacteriana las que permiten que los péptidos tengan tanto éxito en esta lucha.
“Los péptidos actúan rápidamente sobre las membranas de las bacterias invasoras a través de diferentes mecanismos”, dice Torres. "En este caso, las membranas bacterianas actúan como imanes, atrayendo los péptidos antimicrobianos, y debido a que estas propiedades de la membrana son complejas y no se pueden alterar fácilmente para evitar la atracción de los péptidos, las bacterias son vencidas por los péptidos antimicrobianos y destruidas, con múltiples obstáculos en el proceso". manera de desarrollar cualquier resistencia en la próxima generación".
Eliminar el potencial de resistencia significa que estos péptidos podrían usarse como antibióticos para una amplia gama de infecciones bacterianas y seguir siendo eficaces durante más tiempo que los antibióticos tradicionales.
Finalmente, para aumentar la estabilidad para probar la función antimicrobiana in vivo, se diseñó, sintetizó y usó un péptido en un modelo de ratón. El experimento mostró una infección bacteriana de la piel tratada con el péptido sintético basado en los antibióticos naturales identificados a partir de la Apolipoproteína B, que fue capaz de erradicar la infección en cuatro días con una sola dosis.
"La sangre era un lugar claro para buscar péptidos encriptados según lo determinado por el algoritmo, y estos resultados proporcionan un vínculo entre las proteínas plasmáticas humanas y nuestra inmunidad innata", dice de la Fuente. "Seguimos buscando estos péptidos más allá de la sangre, en todos los demás sitios del cuerpo para proporcionar ese vínculo también con los sistemas nervioso, digestivo e inmunológico". Los investigadores muestran que los péptidos 'encriptados' podrían ser fuente de antibióticos naturales