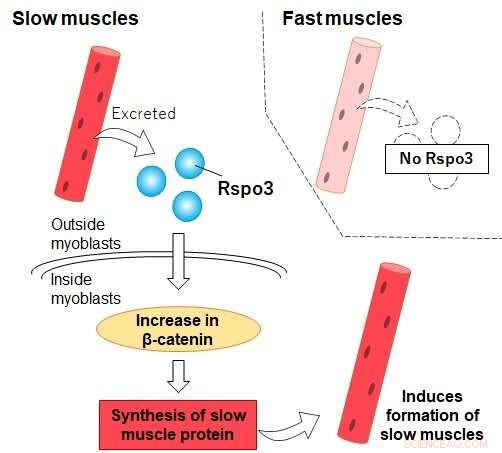
Rspo3 se excreta de las fibras de tipo I "lentas" (no de las fibras "rápidas"), lo que promueve la acumulación de beta-catenina dentro de los mioblastos. Esto conduce a una mayor producción de MyHC I y la eventual diferenciación del mioblasto en una fibra de tipo I. Crédito:Universidad Metropolitana de Tokio
Investigadores de la Universidad Metropolitana de Tokio han descubierto que una proteína excretada por las fibras musculares tipo I (lentas), clave para la resistencia muscular, puede hacer que los mioblastos circundantes se diferencien en fibras tipo I. Esto pone patas arriba la sabiduría prevaleciente que dice que nuestra proporción de fibra rápida/lenta no se puede cambiar significativamente. También identificaron la vía química por la cual la proteína afecta la diferenciación. Tales hallazgos pueden conducir algún día a terapias para controlar la salud muscular lenta.
El tejido del músculo esquelético está formado por cientos de miles de fibras que se contraen cuando se les ordena. Sin embargo, no son todos iguales. Hay fibras musculares "lentas" de tipo I, importantes para el ejercicio de resistencia, y fibras "rápidas" de tipo II, que pueden responder mucho más rápidamente pero por períodos más cortos de tiempo. Las fibras de tipo I podrían compararse con los corredores de maratón, mientras que las fibras de tipo II podrían denominarse velocistas. Durante mucho tiempo, la sabiduría predominante ha sido que la proporción de fibras tipo I y tipo II en nuestros músculos se determina en gran medida al nacer.
Pero los científicos están comenzando a descubrir que este no es el caso. Un equipo de investigadores de la Universidad Metropolitana de Tokio dirigido por el profesor Nobuharu Fujii ha descubierto ahora que una proteína excretada por el músculo tipo I conocida como R-spondin3 (Rspo3) puede ser la clave para el desarrollo de nuevas fibras tipo I. Cuando los mioblastos, precursores de las células musculares, se trataron con Rspo3, comenzaron a producir cantidades significativamente más altas de cadena pesada de miosina I (MyHC I), una proteína producida por el músculo tipo I.
El efecto parecía ser exclusivo de los mioblastos en las primeras etapas de su desarrollo. Esto significa que las fibras tipo I inducen activamente la formación de más fibras tipo I en su vecindad, excretando Rspo3 y actuando sobre la diferenciación de las células cercanas. El hallazgo arroja nueva luz sobre el papel de los músculos en nuestro cuerpo y da un vuelco a la sabiduría convencional que dice que la proporción de fibras tipo I y tipo II no se puede cambiar. El equipo también pudo demostrar que esto sucedió a través de una cascada específica de reacciones químicas conocida como vía Wnt/beta-catenina, responsable de la necesaria acumulación de beta-catenina dentro de las células. Los experimentos para reducir artificialmente la cantidad de beta-catenina en las células, por ejemplo, condujeron a la supresión del aumento de la expresión de MyHC I.
La diabetes tipo 2 y la falta de ejercicio son dos de las muchas razones por las que las fibras musculares lentas pueden atrofiarse. Los hallazgos del equipo sugieren que en realidad es posible fomentar específicamente el desarrollo de fibras tipo I a través de medios terapéuticos. Por ejemplo, Rspo3 se puede usar directamente como tratamiento, o se puede usar para diferenciar las células musculares extraídas de un paciente antes de que se vuelva a implantar el tejido. Si las células pueden excretar Rspo3 y afectar a las células circundantes, los beneficios serán más que solo la masa que se reintroduce. Estos conocimientos prometen nuevas y emocionantes posibilidades de tratamientos para mejorar la función muscular, un desafío clave para las poblaciones y la sociedad que envejecen.
El estudio aparece en Scientific Reports . Los músculos parecen crecer, en lugar de encogerse, en algunos pacientes con COVID en estado crítico