Crédito:Universidad de Colonia
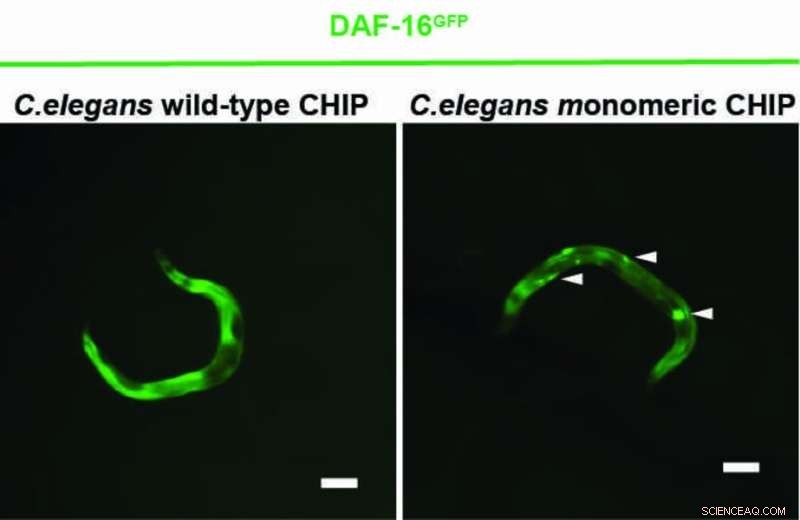
Un nuevo estudio muestra que la proteína CHIP puede regular el receptor de insulina de manera más eficiente sola que en un estado emparejado. En situaciones de estrés celular, CHIP generalmente aparece como un homodímero, una asociación de dos proteínas idénticas, y sirve principalmente para degradar proteínas mal plegadas y defectuosas. CHIP así limpia la celda. Con este fin, CHIP colabora con proteínas auxiliares para unir una cadena de la pequeña proteína ubiquitina a las proteínas mal plegadas. Las proteínas defectuosas son así reconocidas y eliminadas por la célula. Además, CHIP también regula la transducción de señales del receptor de insulina. CHIP une la ubiquitina al receptor para degradarlo y detener la activación de los productos genéticos que prolongan la vida.
Un equipo de investigación con sede en Colonia dirigido por el profesor Dr. Thorsten Hoppe ha demostrado ahora en experimentos con el nematodo Caenorhabditis elegans y células humanas que CHIP también puede etiquetarse con ubiquitina, lo que evita la formación de dímeros. El monómero CHIP es más eficiente que el dímero CHIP en la regulación de la señalización de insulina. El estudio realizado por el Clúster de Excelencia de la Universidad de Colonia para Respuestas al Estrés Celular en Enfermedades Asociadas al Envejecimiento (CECAD) fue publicado en Molecular Cell bajo el título "Un interruptor de dímero-monómero controla la ubiquitilación y el procesamiento de sustratos dependientes de CHIP".
"Si CHIP funciona solo o en pareja depende del estado de la célula. Bajo estrés, hay demasiadas proteínas mal plegadas, así como proteínas auxiliares que se unen a CHIP y evitan la autoubiquitilación, el automarcado con ubiquitina". dijo Vishnu Balaji, primer autor del estudio.
"Después de que CHIP limpia con éxito las proteínas defectuosas, también puede marcar las proteínas auxiliares para su degradación. Esto permite que CHIP se ubiquite y vuelva a funcionar como un monómero", explicó. Por lo tanto, para que el cuerpo funcione sin problemas, debe haber un equilibrio entre los estados monomérico y dimérico de CHIP.
"Es interesante que el equilibrio monómero-dímero de CHIP parezca estar interrumpido en las enfermedades neurodegenerativas", dijo Thorsten Hoppe. "En las ataxias espinocerebelosas, por ejemplo, se mutan diferentes sitios de CHIP, y funciona predominantemente como un dímero. Aquí, un cambio a más monómeros sería un posible enfoque terapéutico".
En el siguiente paso, los científicos quieren averiguar si hay otras proteínas o receptores a los que se une el monómero CHIP y, por lo tanto, regula su función. Los investigadores también están interesados en averiguar en qué tejidos y órganos y en qué enfermedades los monómeros o dímeros CHIP se presentan en mayor número, para poder desarrollar terapias más específicas en el futuro. El vínculo entre la agregación de proteínas y el envejecimiento