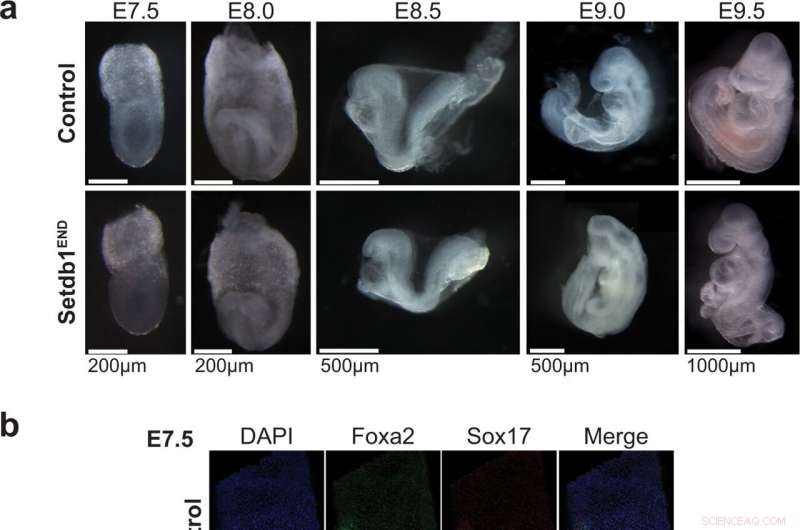
La pérdida de Setdb1 en el endodermo conduce a fuertes defectos de desarrollo durante la embriogénesis. una vista lateral del control y Setdb1 END embriones en E7.5 (etapa de yema tardía), E7.75 (etapa de pliegue de la cabeza), E8.5 (~6 somita) y E9. No se pueden detectar defectos de desarrollo visibles en Setdb1 END embriones de E7.5 a E8.0. Setdb1 FIN los embriones muestran un defecto de giro del eje que se manifiesta desde E8.5 y conduce a un fuerte truncamiento posterior en E9.0. Imágenes representativas de n = 3 por genotipo y estadio. b Vista lateral del control E7.5 y Setdb1 END embriones teñidos con anticuerpos Foxa2 y Sox17 (anterior a la izquierda). La presencia de ambos marcadores indica que podrían formarse células endodérmicas en Setdb1 END embriones Imágenes representativas de n = 3 por genotipo y etapa. c Tinción con hematoxilina/eosina de secciones transversales del control E8.5 y E9.0 y Setdb1 END embriones Las posiciones aproximadas de las secciones se indican en el esquema. El rectángulo negro marca la región utilizada para la ampliación. Las flechas rojas indican la región del intestino posterior. Las puntas de flecha negras marcan el tubo neural. Imágenes representativas de n = 3 por genotipo y etapa. Crédito:Comunicaciones de la naturaleza (2022). DOI:10.1038/s41467-022-32978-7
El biólogo molecular de LMU, Gunnar Schotta, ha investigado qué mecanismos evitan que los retrovirus endógenos se vuelvan demasiado activos.
Los retrovirus endógenos (ERV) se han establecido en el genoma humano en el curso de la evolución y desempeñan un papel importante en la regulación génica normal. Sin embargo, la actividad excesiva de ERV puede provocar enfermedades como la autoinmunidad y el cáncer. Y así, las células han desarrollado mecanismos para reconocer y silenciar los retrovirus endógenos.
El silenciamiento se logra empaquetando las secciones de ADN correspondientes en una estructura menos accesible. Este proceso se ve facilitado por modificaciones en las proteínas histonas que empaquetan el ADN (H3K9me3) y una modificación en el propio ADN (metilación del ADN). Sin embargo, hasta ahora no estaba claro cuáles de estas modificaciones son realmente importantes para el silenciamiento de ERV.
El equipo, dirigido por Gunnar Schotta del Centro Biomédico de LMU en Múnich, descubrió que en ciertos tipos de células, la metilación del ADN es decisiva y la presencia de H3K9me3 no es suficiente para silenciar los ERV. Este descubrimiento proporciona una base importante, por ejemplo, para la investigación de ERV activados de forma anómala en el contexto de enfermedades como el cáncer y la autoinmunidad.
El estudio fue publicado en Nature Communications . Regulación génica:Identificado el factor silenciador para retrovirus endógenos