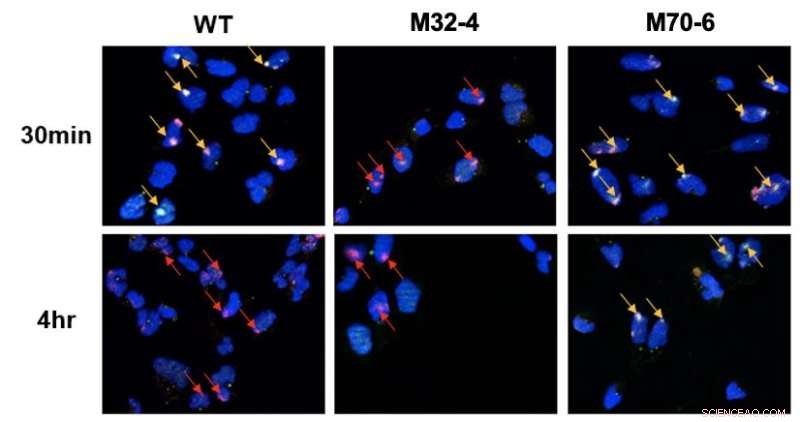
Rol distintivo de las interacciones de RPA32 y RPA70 con XPA en NER. Las células se irradiaron con UV y la colocalización de XPA con sitios dañados por UV se visualizó mediante microscopía de fluorescencia. El daño en el ADN se destaca con flechas rojas y la localización conjunta de XPA con ADN UV se indica con flechas amarillas. En células mutantes XPA-RPA32 (M32-4), se observó un reclutamiento reducido de XPA para dañar el ADN. En las células mutantes XPA-RPA70 (M70-6), el XPA permaneció unido a los sitios dañados durante un tiempo prolongado. Esto indica que se requiere la interacción de RPA32 con XPA para el reclutamiento de XPA para el daño inducido por UV, mientras que la interacción de RPA70 con XPA es importante para el posicionamiento de XPA para completar NER. Crédito:Instituto de Ciencias Básicas
La reparación por escisión de nucleótidos (NER) es una de las principales vías conservadas de reparación del ADN, que repara varios tipos de daños en el genoma, como los inducidos por la luz ultravioleta y los agentes ambientales. La disfunción en esta vía puede ser perjudicial para la salud humana. Por ejemplo, las personas con defectos en NER sufren xeroderma pigmentoso, una enfermedad caracterizada por una disposición extrema al cáncer de piel inducido por la luz solar debido a la incapacidad de reparar el ADN dañado por los rayos UV.
Si bien NER contrarresta la formación de cáncer, también es importante para la terapia antitumoral. Muchos agentes antitumorales, como el cisplatino, inducen daño al ADN que puede ser reparado por NER. En este contexto, NER es un objetivo farmacológico de interés para mejorar los resultados de la terapia contra el cáncer. A nivel molecular, NER es una máquina molecular altamente compleja y dinámica, que involucra más de 30 proteínas que se ensamblan en las lesiones del ADN para extirpar el daño y reemplazarlo con ADN intacto. Este proceso está guiado por interacciones proteína-proteína y proteína-ADN.
Un equipo de investigadores dirigido por el Director Asociado Orlando D. Schärer y la estudiante graduada Kim Mihyun del Centro para la Integridad Genómica del Instituto de Ciencias Básicas de Corea del Sur exploró estas interacciones. El equipo descubrió que se requieren dos proteínas clave en NER, a saber, la proteína A de xeroderma pigmentoso (XPA) y la proteína A de replicación (RPA), para organizar el complejo previo a la incisión en NER.
Las dos proteínas XPA y RPA son responsables de la organización del complejo NER después de haber encontrado el daño en el ADN. El presente estudio comparó variantes mutantes de estas dos proteínas para investigar cómo las dos proteínas participan en una interacción fundamental para la vía NER. Específicamente, se descubrió que dos interfaces de interacción entre XPA y RPA son críticas para NER y tienen funciones distintas en la vía. La interacción de XPA con RPA32 es crucial para la asociación inicial de XPA con daño en el ADN, mientras que la interacción entre XPA y RPA70 es importante para completar NER.
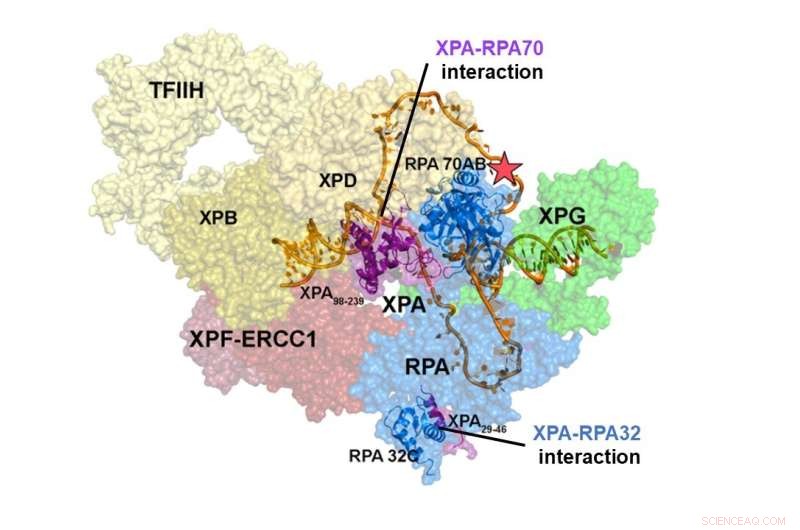
Estructura del complejo de preincisión NER. La interacción de XPA y RPA70 se localiza en el centro del complejo NER, mientras que el sitio de interacción de XPA y RPA32 se encuentra en la periferia. Las interacciones entre XPA y RPA70 estabilizan el complejo previo a la incisión y contraen el ADN para adoptar una forma de U, que parece ser la forma activa del complejo, lo que le permite eliminar el daño del ADN. Crédito:Instituto de Ciencias Básicas
Los estudios estructurales integradores de un complejo XPA-RPA-DNA revelaron cómo las interacciones de las dos proteínas dan forma al complejo NER y desencadenan la escisión del daño. La interacción de XPA y RPA32 ocurre en la periferia del complejo, donde facilita el ensamblaje inicial de las proteínas en el sitio del daño. La interacción entre XPA y RPA70 se encuentra en el corazón del complejo NER y obliga al ADN a adoptar una forma de U. Esto permite que las dos uniones ss/dsDNA se localicen muy cerca, lo que permite que el complejo NER corte el ADN para eliminar el daño.
Schärer afirmó que su "estudio reveló un nuevo modelo sorprendente del complejo NER y cómo la interacción entre XPA y RPA da forma a su arquitectura. La interrupción de la interacción entre XPA y RPA inhibe NER, y nuestro estudio proporciona un modelo de cómo esta interacción puede ser dirigidos por moléculas pequeñas para mejorar la terapia contra el cáncer. Continuamos realizando investigaciones de seguimiento junto con nuestro colaborador a largo plazo en este proyecto, el profesor Walter Chazin en la Universidad de Vanderbilt".
Esta investigación fue publicada en Proceedings of the National Academy of Sciences . Las etiquetas moleculares revelan cómo se seleccionan y marcan los lisosomas dañados para su eliminación