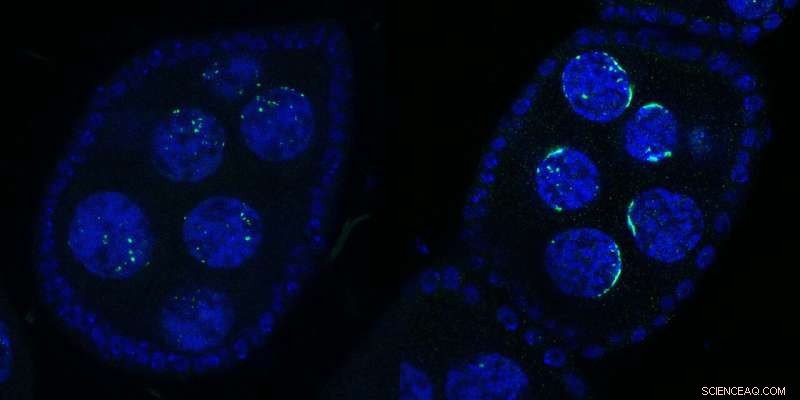
Dos cámaras de huevos de Drosophila que contienen varios núcleos:de tipo salvaje (izquierda) o tras la inactivación de Kipferl (derecha). El ADN se muestra en azul y Rhino en verde. Tras la mutación o eliminación de la proteína asociada Kipferl (derecha), Rhino pierde su afinidad por las secuencias de grupos de piRNA en todo el genoma (puntos verdes en el panel de la izquierda), pero es secuestrado por los conjuntos de satélites pericentroméricos (formas verdes en forma de media luna en el panel de la derecha). panel). Las formas de media luna inspiraron el nombre “Kipferl”, el nombre de una pastelería austriaca. Crédito:Baumgartner/Brennecke/IMBA
Una gran parte de nuestro ADN se compone de elementos de ADN repetitivos y egoístas, algunos de los cuales pueden saltar de un sitio del genoma a otro, lo que podría dañarlo. Investigadores del Instituto de Biotecnología Molecular de la Academia de Ciencias de Austria (IMBA) describen cómo diferentes tipos de elementos de ADN repetitivos son controlados por el mismo mecanismo de silenciamiento en los ovarios de la mosca de la fruta.
El centro de sus hallazgos es una proteína no caracterizada que los investigadores llamaron "Kipferl", que asegura el control efectivo de los genes saltadores. Los hallazgos sugieren que diferentes elementos egoístas compiten por el sistema de defensa del genoma del huésped y que Kipferl podría ser la primera de una serie de moléculas que actúan de manera similar aún por descubrir. Los hallazgos se publican en eLife .
Aproximadamente la mitad del genoma humano y una quinta parte del genoma de la mosca de la fruta están compuestos de parásitos genéticos que se asemejan a genes que pueden hacer copias de sí mismos e insertarse en áreas aleatorias de nuestro genoma, lo que podría alterar la expresión génica normal. Múltiples mecanismos de defensa han evolucionado para mantener bajo control estos llamados transposones.
Uno de esos mecanismos es un sistema de interferencia de ARN llamado vía piRNA. La vía piRNA es una pequeña vía de silenciamiento de ARN conservada en todo el reino animal, desde esponjas hasta mamíferos. Este mecanismo de silenciamiento utiliza piRNA generados a partir de secuencias ricas en transposones en el ADN llamados "grupos de piRNA".
Los piRNA son pequeños ARN que se acoplan con las llamadas proteínas Argonaute de la maquinaria silenciadora para dirigirse a los transposones complementarios a su secuencia. Por lo tanto, estos piRNA sirven como modelos para identificar y silenciar transposones con secuencias complementarias en el genoma, sin importar qué tan lejos puedan saltar.
La mosca de la fruta Drosophila melanogaster, en la que se identificó por primera vez la vía del piRNA, utiliza una proteína llamada "Rhino" para encontrar grupos de piRNA en el genoma. Sin embargo, aún se desconocía cómo Rhino reconoce los grupos de piRNA en el ADN.
"Los datos in vitro anteriores habían mostrado una afinidad de Rhino por una marca epigenética específica, la modificación de la cromatina H3K9me3", dice el líder del grupo IMBA, Julius Brennecke, autor correspondiente del estudio. Esta modificación es un marcador de "heterocromatina", una forma de ADN muy compacto en el que los genes están silenciados.
Sin embargo, H3K9me3 no es específico de los grupos de piRNA, sino que también se encuentra con frecuencia en otras regiones densamente empaquetadas del genoma. Allí, H3K9me3 se une a la principal proteína de heterocromatina 1 (HP1), un pariente cercano de Rhino.
Durante mucho tiempo no quedó claro por qué HP1 y Rhino se unen a diferentes subconjuntos de heterocromatina, a pesar de que ambos tienen una afinidad comparable por la misma modificación de cromatina. "Sin lugar a dudas, se requería H3K9me3, pero no lo suficiente para explicar la unión de Rhino a la cromatina. Por lo tanto, sabíamos que debe haber señales moleculares adicionales que ayuden a dirigir Rhino a los grupos de piRNA", agrega Brennecke.
En la búsqueda de esta señal molecular, el equipo catalogó a los interactuantes directos de Rhino, en busca de una proteína asociada que pudiera guiar a Rhino a los grupos de piRNA. Usando una combinación de enfoques genéticos, genómicos y de imágenes, los investigadores identificaron al "compañero" de Rhino en los ovarios de Drosophila:una proteína que contiene varios pliegues de dedos de zinc que llamaron "Kipferl".
Kipferl no solo se une a Rhino, sino que también utiliza sus dedos de zinc para la unión específica de secuencia a motivos de ADN ricos en guanosina. El equipo descubrió que la mayoría de los grupos de piRNA se definen mediante la combinación de sitios de unión de ADN específicos de Kipferl con heterocromatina local. En estos sitios, Kipferl estabiliza la interacción de Rhino con las marcas epigenéticas H3K9me3, lo que explica por qué Rhino solo se une a una pequeña parte de toda la heterocromatina que se encuentra en el genoma.
Para agregar un nivel de complejidad, el equipo sabía que Rhino no solo se localiza en grupos de piRNA. Recientemente, se ha demostrado que Rhino se une a los llamados "conjuntos de satélites". Estas son secuencias repetitivas de ADN no codificante y no transpositor ubicadas cerca de los centrómeros de los cromosomas.
"Vimos un efecto sorprendente en Rhino cuando generamos moscas con Kipferl mutante o ausente y las observamos bajo el microscopio", dice la primera autora Lisa Baumgartner, candidata a doctorado en el laboratorio Brennecke en IMBA. Cuando se mutó Kipferl, Rhino ya no se localizó en los grupos de piRNA en todo el genoma. En cambio, se acumuló fuertemente en las matrices de satélites genómicos.
"En lugar de puntos más pequeños distribuidos alrededor del núcleo, vimos a Rhino formando distintas formas en forma de media luna. Con base en esta primera observación, llamamos a la nueva proteína 'Kipferl', en honor a un popular pastel austriaco en forma de croissant. Solo descubrimos mucho más tarde que estas estructuras correspondían a tramos Mega-base de conjuntos de satélites". Por lo tanto, los científicos demostraron que Kipferl ayudó a distribuir correctamente Rhino a los grupos de piRNA y evitar su secuestro en conjuntos de satélites.
Rhino es una de las proteínas de más rápida evolución en el genoma de la mosca. Brennecke y su equipo plantean la hipótesis de que esta rápida evolución bien podría deberse a la presión evolutiva positiva proveniente de los conjuntos de satélites.
"Las matrices de satélites no se transponen, pero pueden recombinarse. Sin embargo, si lo hacen de manera descontrolada, se podrían perder brazos de cromosomas completos. Por lo tanto, las matrices de satélites podrían necesitar un mecanismo de control que involucre a Rhino y otros componentes de la vía del ARNip para ayudar a empaquetarlos. en heterocromatina compacta. Esta podría ser la razón por la que las matrices de satélites parecen querer secuestrar todo el Rhino que puedan encontrar", explica Baumgartner.
Baumgartner cree que Rhino y la ruta del piRNA podrían tener roles muy diferentes en sus interacciones con los conjuntos de satélites o los grupos de piRNA y los transposones. “El salto y la multiplicación de los transposones suponen un peligro para la funcionalidad del genoma, por lo que es necesario que la vía del piRNA los silencie”, dice.
"Por lo tanto, a los ojos de los transposones, la ruta del piRNA es el 'enemigo' que evita que se propaguen a través del genoma. Las matrices de satélites, por otro lado, simplemente necesitan una capa adicional de control para garantizar que puedan mantener su copia alta número sin dañar el genoma a través de una recombinación no deseada. Por lo tanto, a los ojos de los conjuntos de satélites, me imagino que Rhino es un factor que asegura su supervivencia", explica.
Con base en estas observaciones y análisis, los científicos sugieren que las matrices de satélites podrían estar usando otra proteína asociada como Kipferl para ayudar a localizar a Rhino en su ADN.
"Para contrarrestar el secuestro de Rhino por los conjuntos de satélites, especulamos que Kipferl podría haber evolucionado por la necesidad de ayudar a redirigir a Rhino a los grupos de piRNA. Por lo tanto, nuestros hallazgos sugieren que Rhino podría verse atrapado en un fuego cruzado de conflictos genéticos". dice Brennecke. Además, Rhino se expresa tanto en los testículos como en los ovarios de la mosca de la fruta, mientras que Kipferl solo se expresa en los ovarios. "Kipferl podría ser el primero de varios factores de orientación de Rhino aún por descubrir", concluye Brennecke. Cómo las células piratean sus propios genes