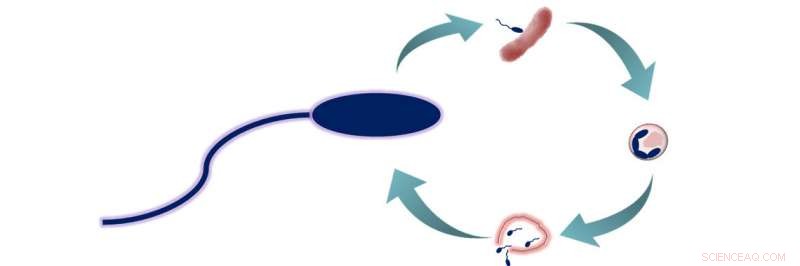
Ciclo de depredación de B. bacteriovorus. B. bacteriovorus tiene dos fases de vida:1) búsqueda de presas, y 2) entrar a la presa y alimentarse. Durante esta segunda fase, las bacterias consumen a sus presas desde el interior, permitiéndoles crecer y alargarse antes de separarse en 3 a 6 nuevas células de B. bacteriovorus. Estas células luego escapan de la presa ahora muerta y comienzan un nuevo ciclo de vida. Crédito:Sociedad Química Estadounidense
En 2016, la Organización Mundial de la Salud nombró la resistencia a los antibióticos como "una de las mayores amenazas para la salud mundial, seguridad alimentaria, y desarrollo hoy ". El anuncio citó una lista creciente de infecciones, como tuberculosis y gonorrea, que se vuelven más difíciles de tratar cada año a medida que aumenta la resistencia a los tratamientos con antibióticos actuales. Sin embargo, los antibióticos son esenciales, sin ellos, la raza humana estaría plagada de infecciones persistentes. Entonces, ¿cuál es la solución para garantizar un tratamiento continuo y al mismo tiempo abordar el alarmante aumento de la resistencia?
Una posible solución radica en un tipo único de bacteria depredadora que se alimenta de otras bacterias, como los que causan enfermedades. Apodado "antibióticos vivos, "este grupo de fauna carnívora ha llamado la atención de los investigadores, incluidos los de la Universidad de Graduados del Instituto de Ciencia y Tecnología de Okinawa (OIST). En un artículo publicado recientemente en Biología sintética ACS , Los investigadores de OIST han dado los primeros pasos hacia la manipulación genética de uno de esos pequeños caníbales, B. bacteriovorus. Han identificado herramientas que pueden permitir la manipulación de genes que influyen en el comportamiento depredador de esta bacteria.
"En el futuro, queremos controlar la depredación de las bacterias:el momento y el alcance de la depredación, "explica el Dr. Mohammed Dwidar de la Unidad de Ingeniería y Química de Ácidos Nucleicos y primer autor del artículo." [En este momento] carecemos de las herramientas básicas de ingeniería para hacer esto ".
B. bacteriovorus es inofensivo para los humanos pero letal para sus presas, las bacterias Gram-negativas, que incluyen a los malos como E. coli, Salmonela, Legionella, y otros. Como tal, ser capaz de controlarlo podría potencialmente tratar muchos tipos diferentes de infecciones. Sin embargo, debido a su inusual naturaleza depredadora y otras características únicas, la manipulación genética de B. bacteriovorus ha sido limitada.
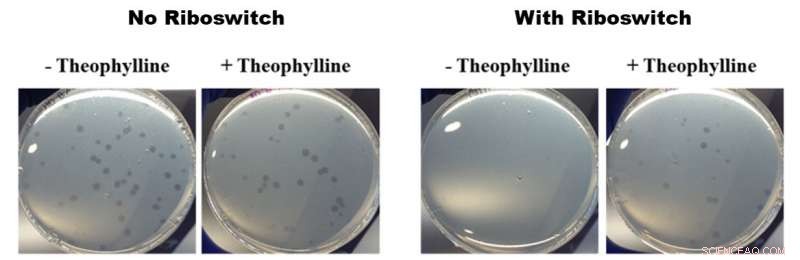
Efectos de los riboswitches activados por teofilina sobre el crecimiento de B. bacteriovorus. Todas las fotografías de la figura anterior muestran placas de Petri que contienen B. bacteriovorus y su presa E. coli. Las dos fotos de la izquierda muestran el crecimiento de B. bacteriovorus en placas que no contienen (-) y contienen (+) teofilina sin un riboswitch insertado en el genoma. Las dos fotografías de la derecha muestran el crecimiento de B. bacteriovorus modificado con un riboswitch en platos que no contienen (-) y contienen (+) teofilina. Las fotos de la izquierda no muestran diferencias en el crecimiento y las fotos de la derecha muestran un crecimiento más rápido en presencia de teofilina. lo que significa que los riboswitches activados por teofilina tuvieron un efecto sobre el comportamiento depredador de B. bacteriovorus. Crédito:Sociedad Química Estadounidense
Los investigadores de OIST utilizaron riboswitches, que son herramientas de control de la expresión génica que se sabe que funcionan bien en otras bacterias, para abordar el desafío de comprender y manipular la depredación de B. bacteriovorus. La forma en que se expresa un gen sigue una ruta específica:el ADN se convierte en ARN mediante la transcripción, El ARN se convierte en proteínas mediante la traducción. y luego las proteínas llevan a cabo diferentes funciones. El riboswitch entra en la fase de traducción. Al poner un riboswitch al comienzo de una hebra de ARN, y luego "activarlo" con un producto químico, el riboswitch puede iniciar o detener la traducción del ARN en una proteína.
Para su estudio, Los investigadores de la OIST insertaron un riboswitch en uno de los genes que se cree que son importantes para el comportamiento depredador de B. bacteriovorus:el factor sigma flagelar fliA. Luego lo activaron con la teofilina química. Después de colocar las bacterias modificadas en placas de Petri junto con una deliciosa presa de E. coli, el B. bacteriovorus modificado pareció multiplicarse más rápidamente en presencia de teofilina que en su ausencia. Esta multiplicación más rápida implica que B. bacteriovorus estaba consumiendo a su presa más rápido, y así multiplicarse más rápido. Esto, a su vez, muestra que la teofilina puede controlar el ciclo de vida de los depredadores.
Además del objetivo final del "antibiótico vivo", Hay muchos más usos potenciales para las células de B. bacteriovorus fácilmente manipulables. "La gente quiere alimentos orgánicos sin productos químicos, "El Dr. Dwidar explica." Las bacterias depredadoras pueden ser una alternativa potencialmente segura a los agentes antibacterianos para algunas enfermedades de las plantas. También podemos usarlo para la industria, por ejemplo, en plantas de tratamiento de agua ".
"En el futuro, podría rociar estas bacterias en alimentos frescos para protegerlos contra la intoxicación alimentaria, "Profesor Yohei Yokobayashi, quien también estuvo involucrado en la investigación, agrega.
Con los resultados de los investigadores de la OIST en la mano, el siguiente paso es aprender más sobre B. bacteriovorus y las herramientas que podrían ser capaces de controlar su comportamiento para que algún día se dé cuenta de todo su potencial antibiótico.