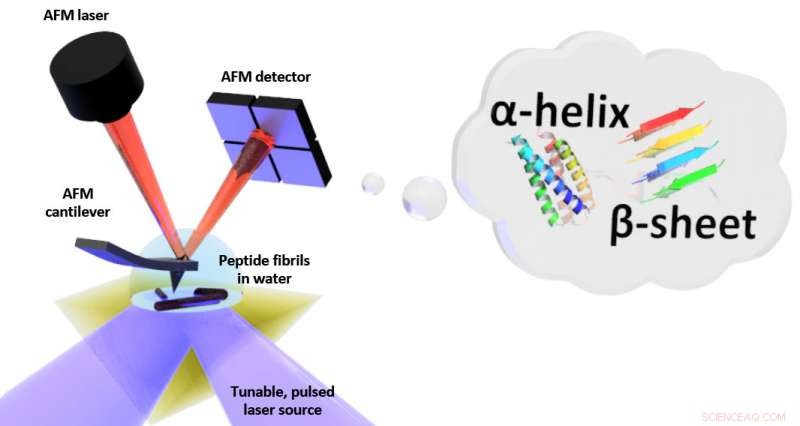
Esquema de la configuración para resonancia inducida por fototérmica (PTIR), que incluye una fuente de láser infrarrojo y un microscopio de fuerza atómica (AFM) en voladizo con una punta afilada que toca la muestra y vibra en respuesta a la expansión inducida por la luz de la muestra. PTIR puede determinar el patrón de plegado (llamado por ejemplo α-hélice, hoja β) de péptidos (cadenas de aminoácidos) en agua con resolución a escala nanométrica. Crédito:NIST
Jugando con un método que ayudaron a desarrollar en los últimos años, Los científicos han medido por primera vez a escala nanométrica los patrones característicos de los pliegues que dan a las proteínas su forma tridimensional en el agua. Desarrollado por investigadores del Instituto Nacional de Estándares y Tecnología (NIST) y sus colegas, esta técnica ayudará a los científicos a comprender mejor el comportamiento de las biomoléculas en entornos acuosos similares a los de las células. Estas percepciones Sucesivamente, podría aumentar nuestra comprensión de las principales enfermedades, incluyendo la enfermedad de Alzheimer, que están relacionados con "errores" en el plegamiento de proteínas.
La vida tal como la conocemos no podría sobrevivir si las proteínas no se plegaran en patrones precisos que conduzcan a hélices, láminas y otras formas que dan a las proteínas su estructura tridimensional. Las formas precisas de las proteínas les permiten transportar oxígeno, defenderse de las bacterias dañinas y realizar otras tareas esenciales en el cuerpo. Las proteínas que se pliegan incorrectamente no pueden funcionar y, a veces, generan fragmentos tóxicos. como los asociados con trastornos neurodegenerativos.
Para comprender las complejidades del plegado, Los científicos necesitan estudiar la disposición detallada de las cadenas de aminoácidos que son más cortas y simples que las proteínas, llamadas péptidos, y cómo se pliegan. ensamblar y rotar para crear una variedad de formas, o conformaciones. Los biólogos prefieren examinar proteínas y péptidos sumergidos en agua porque ese entorno se aproxima mucho a las condiciones dentro de las células vivas.
Técnicas previamente establecidas para determinar la conformación de proteínas, como la espectroscopia infrarroja, carecen de la fina resolución espacial para estudiar los diminutos y diversos conjuntos de proteínas correctamente plegadas y mal plegadas. Además, estas técnicas no funcionan bien en un ambiente acuoso porque el agua absorbe fuertemente la luz infrarroja, confundir el análisis. El agua también había planteado graves desafíos para una técnica pionera, conocido como resonancia foto-térmica inducida (PTIR), que recientemente permitió a los investigadores examinar la estructura y conformación de los péptidos en el aire con una resolución a nanoescala.
Los investigadores del NIST y sus colegas han demostrado ahora que PTIR se puede adaptar para obtener una estructura conformacional a nanoescala en agua utilizando dos péptidos químicamente similares conocidos como difenilalanina y Boc-difenilalanina. La difenilalanina está relacionada con la beta-amiloide, un pegajoso péptido más grande relacionado con la enfermedad de Alzheimer.
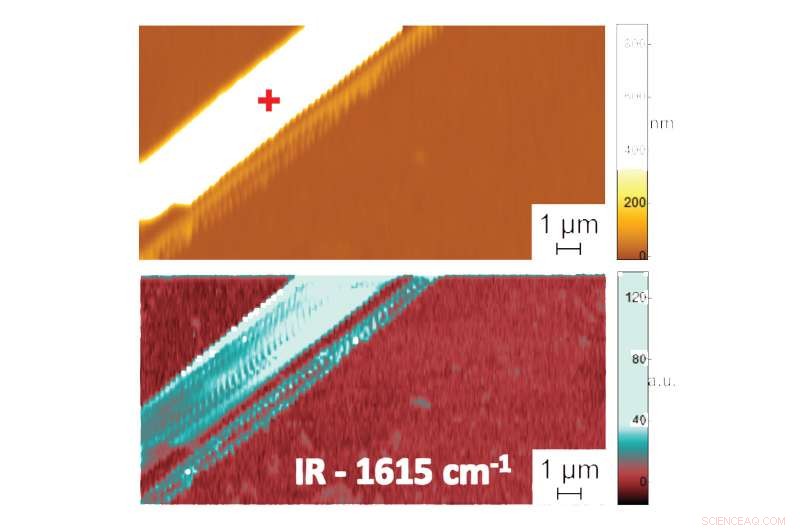
Aparece en:La forma en el agua:primeras mediciones a escala nanométrica de la estructura plegada de biomoléculas en líquidos. Imagen de microscopio de fuerza atómica que muestra la topografía (arriba) y la imagen de absorción PTIR que indica la composición y conformación (abajo) de una fibrilla de péptido de difenilalanina en agua. Datos adicionales, registrar el espectro de radiación infrarroja absorbida por las fibrillas peptídicas, proporciona información sobre su patrón de plegado. El espectro PTIR indicó, por ejemplo, que la difenilalanina asume una conformación de hoja β anti-paralela pura. Crédito:NIST
"PTIR es una técnica poderosa que ya se había mostrado prometedora para el estudio de sistemas biológicos, pero la posibilidad de usar esto con muestras en un ambiente líquido mejorará enormemente su uso en esta área, ", dijo Georg Ramer del NIST y la Universidad de Maryland en College Park. Ramer y la investigadora del NIST Andrea Centrone, junto con sus colegas de la Universidad de Cambridge en Inglaterra, describió su trabajo en un artículo publicado recientemente en línea en ACS Nano .
PTIR determina la composición química de materiales con resolución a nanoescala combinando un microscopio de fuerza atómica (AFM) con luz de un láser infrarrojo que opera en un rango de longitudes de onda. Las longitudes de onda características de la luz infrarroja que son absorbidas por la muestra son similares a una huella dactilar molecular, revelando su composición química. En cada lugar de la muestra donde se absorbe el infrarrojo, el material se calienta, provocando que se acelere, pero muy levemente expandir. Se detecta la expansión, con la punta afilada del AFM sobresaliendo de un voladizo, que oscila como un trampolín cada vez que la muestra se expande. Cuanta más luz absorba la muestra, cuanto mayor sea su expansión y mayor sea la fuerza, o amplitud, de las oscilaciones.
Tan bueno como es PTIR, Usar el método en un ambiente acuático es problemático. El agua absorbe fuertemente la luz infrarroja, produciendo una señal de absorción que puede interferir con los esfuerzos por discernir la estructura química de la muestra. Además, la fuerza de arrastre ejercida por el agua es mucho más fuerte que en el aire y normalmente debilita la señal PTIR, ya que amortigua fuertemente las oscilaciones del voladizo del AFM.
Para limitar la absorción de luz infrarroja por el agua, el equipo colocó un prisma entre el láser y la muestra. El prisma sirvió para confinar la luz infrarroja a la superficie de la muestra, minimizando la cantidad que podría filtrarse e interactuar con el agua. Para abordar el problema de la amortiguación, el equipo usó un láser que podía operar a frecuencias de hasta 2, 000 kilohercios. Eso permitió a los investigadores hacer coincidir la frecuencia de los pulsos láser con una de las frecuencias más altas en las que oscila el voladizo. Como empujar a un niño en un columpio en el intervalo justo, la coincidencia de frecuencia mejoró la amplitud de las oscilaciones del voladizo, compensando parcialmente la amortiguación debida al agua.
Para demostrar la precisión de su método, el equipo comparó las mediciones de PTIR de difenilalanina y otras muestras de péptidos en dos entornos:agua y aire. (Los péptidos se plegaron de manera similar en ambos medios, facilitando la comparación). los científicos lograron una resolución espacial y un contraste similares en el agua y el aire, demostrando por primera vez que las mediciones en un entorno acuático se pueden realizar con precisión, revelando la conformación precisa de péptidos con resolución a nanoescala.
"Este hallazgo es importante para los biólogos que desean comprender la estructura y el plegamiento de las proteínas en entornos lo más cercanos posible a los de las células". "dijo Centrone.