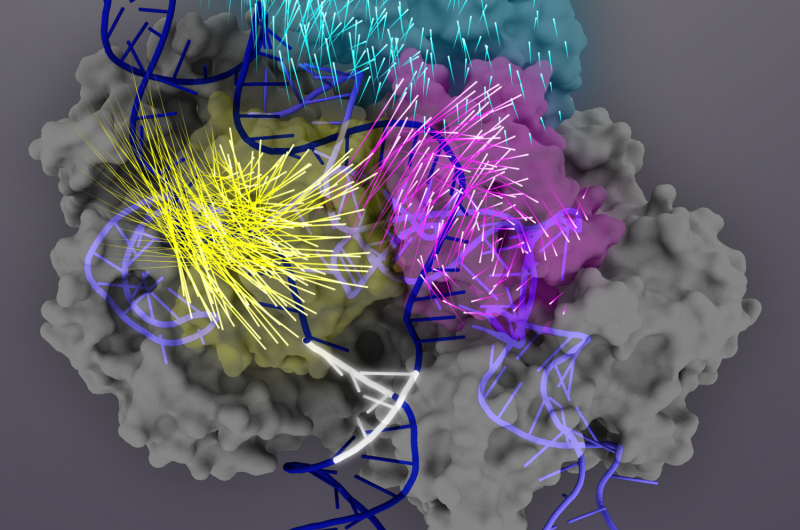
La proteína Cas9 (gris) es una nucleasa guiada por ARN que se puede programar para unirse y cortar cualquier secuencia de ADN coincidente (doble hélice azul oscuro), convirtiéndola en una poderosa herramienta para la ingeniería del genoma. Tras la unión del objetivo, Los dominios de la proteína Cas9 experimentan reordenamientos conformacionales (los movimientos de los aminoácidos individuales están representados por colas de cohete) para activar el complejo Cas9-sgRNA para la escisión de la diana. El dominio REC3 (verde azulado) es responsable de la detección del objetivo, que señala la rotación hacia afuera del dominio REC2 (magenta) para abrir un camino para el dominio nucleasa HNH (amarillo). Esta conformación activa de Cas9 es entonces capaz de desencadenar la escisión concertada de ambas cadenas del ADN diana. Crédito:Gráfico de Janet Iwasa para Doudna Lab
Científicos de la Universidad de California, Berkeley y el Hospital General de Massachusetts han identificado una región clave dentro de la proteína Cas9 que gobierna la precisión con la que CRISPR-Cas9 se ubica en una secuencia de ADN objetivo. y lo he ajustado para producir un editor de genes hiperpreciso con el nivel más bajo de corte fuera del objetivo hasta la fecha.
El dominio de la proteína que los investigadores identificaron como un controlador maestro del corte de ADN es un objetivo obvio para la reingeniería para mejorar la precisión aún más. dicen los investigadores. Este enfoque debería ayudar a los científicos a personalizar las variantes de Cas9, la proteína que se une y corta el ADN, para minimizar la posibilidad de que CRISPR-Cas9 edite el ADN en el lugar equivocado. una consideración clave al realizar la terapia génica en humanos.
Una estrategia para lograr una mayor precisión es crear mutaciones en el dominio de la proteína gobernante, llamado REC3, y vea cuáles mejoran la precisión sin afectar la eficiencia del corte en el objetivo.
"Hemos descubierto que incluso alteraciones menores en el dominio REC3 de Cas9 afectan la diferencia entre la edición dentro y fuera del objetivo, lo que sugiere que este dominio es un candidato obvio para la mutagénesis en profundidad para mejorar la especificidad de la focalización. Como extensión de este trabajo, se podría realizar una mutagénesis más imparcial dentro de REC3 que las mutaciones dirigidas que hemos realizado, "dijo la co-primera autora Janice Chen, estudiante de posgrado en el laboratorio de Jennifer Doudna, quien co-inventó la herramienta de edición de genes CRISPR-Cas9.
Co-primeros autores Chen, Yavuz Dagdas y Benjamin Kleinstiver, y sus colegas de UC Berkeley, El Hospital General de Massachusetts y la Universidad de Harvard informan sus resultados en línea hoy antes de su publicación en la revista. Naturaleza .
Cas9 hiperpreciso
Desde 2012, cuando Doudna, profesor de biología molecular y celular e investigador del Instituto Médico Howard Hughes en UC Berkeley, y su colega Emmanuelle Charpentier del Instituto Max Planck de Biología de Infecciones reutilizaron la proteína Cas9 para crear una editor de genes preciso y fácil de usar, los investigadores han tratado de reducir las posibilidades de edición fuera del objetivo. Si bien una mayor fidelidad beneficia a la investigación básica, es absolutamente fundamental a la hora de editar genes para aplicaciones clínicas, ya que cualquier corte de ADN fuera del objetivo podría deshabilitar genes clave y conducir a permanentes, efectos secundarios inesperados.
En los últimos dos años, dos equipos diseñaron proteínas Cas9 de alta precisión, una de especificidad mejorada llamada eSpCas9 (1.1) y otra de alta fidelidad llamada SpCas9-HF1, y Chen y Doudna buscaron saber por qué cortan con mayor especificidad que la proteína Cas9 de tipo salvaje de Streptococcus pyogenes se utiliza ampliamente en la actualidad.
En la actualidad, los investigadores que utilizan CRISPR-Cas9 crean un ARN de guía única (sgRNA), una molécula de ARN que incluye una cadena de 20 ácidos ribonucleicos que complementa una secuencia específica de ADN de 20 ácidos nucleicos a la que quieren apuntar, y la unen a Cas9. Esta guía de ARN permite a Cas9 ubicarse en el ADN complementario, átelo y corte la hélice de doble hebra. Pero el complejo Cas9-sgRNA también puede unirse al ADN que no coincide exactamente, conduciendo a cortes indeseables fuera del objetivo.
En 2015, El laboratorio de Doudna descubrió un interruptor conformacional de Cas9 que se activa cuando la guía de ARN y el objetivo de ADN coinciden. Descubrieron que solo cuando el ARN y el ADN coinciden estrechamente, la estructura 3D de Cas9, en particular la conformación del dominio nucleasa HNH, cambia y activa las tijeras de Cas9. Sin embargo, el proceso responsable de detectar los ácidos nucleicos aguas arriba del interruptor conformacional seguía siendo desconocido.
En el estudio actual, Chen y Dagdas utilizaron una técnica llamada FRET de molécula única (transferencia de energía de resonancia de Förster) para medir con precisión cómo los diversos dominios de proteínas en el complejo de proteínas Cas9-sgRNA, en particular REC3, REC2 y HNH:se mueven cuando el complejo se une al ADN.
Primero determinaron que los beneficios de especificidad conferidos por eSpCas9 (1.1) y SpCas9-HF1 podrían explicarse por el hecho de que el umbral para el cambio conformacional de HNH era mucho más alto para estas variantes de Cas9 que para la proteína Cas9 de tipo salvaje. haciendo que las variantes eSpCas9 (1.1) y SpCas9-HF1 sean menos propensas a activar las tijeras cuando se unen a una secuencia fuera del objetivo.
Próximo, descubrieron que el dominio REC3 es responsable de detectar la precisión de la unión del objetivo, que luego señala la rotación hacia afuera del dominio REC2 para abrir un camino para el dominio nucleasa HNH, activando las tijeras. Esta conformación activa de Cas9 es capaz de escindir ambas cadenas del ADN diana.
Chen, Dagdas y Kleinstiver luego demostraron que al mutar partes de REC3, Es posible cambiar la especificidad de la proteína Cas9 para que la nucleasa HNH no se active a menos que la coincidencia entre el ARN guía y el ADN diana sea muy similar. Pudieron diseñar un Cas9 hiperpreciso mejorado, apodado HypaCas9, que conserva su eficacia en el objetivo, pero es ligeramente mejor para discriminar entre sitios dentro y fuera del objetivo en células humanas.
"Si mutas ciertos residuos de aminoácidos en REC3, puede ajustar el equilibrio entre la actividad en el objetivo de Cas9 y la especificidad mejorada; pudimos encontrar el punto óptimo donde hay suficiente actividad en el objetivo previsto, pero también una gran reducción de eventos fuera del objetivo, "Dijo Chen.
Al continuar explorando las relaciones entre la estructura, función y dinámica de Cas9, Doudna y su equipo esperan diseñar aún más la proteína con una sensibilidad exquisita para realizar de manera confiable y eficiente una variedad de alteraciones genéticas.