Crédito:Laboratorio Nacional de Oak Ridge
Si bien todos los virus tienen algunos medios para combatir el sistema inmunológico del cuerpo, Los científicos han estado estudiando cómo el coronavirus SARS-CoV-2, la causa de la pandemia global COVID-19, puede evadir el sistema inmunológico de los seres humanos.
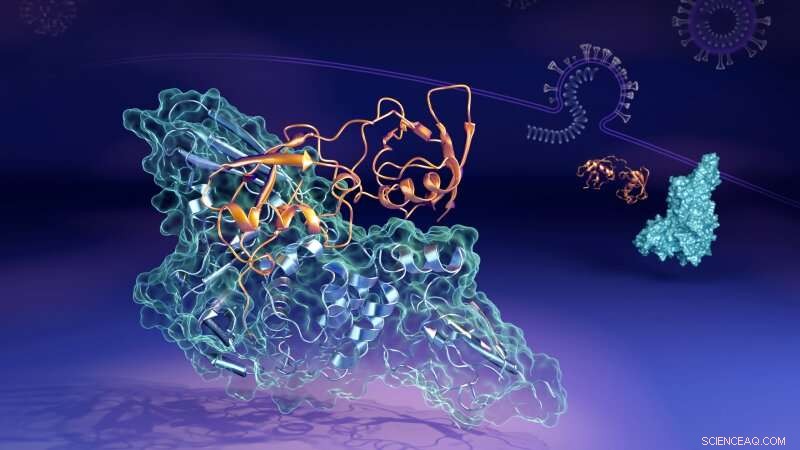
Ahora, los científicos que trabajan en el Laboratorio Nacional Oak Ridge (ORNL) del Departamento de Energía de EE. UU. (DOE) han revelado los detalles moleculares de cómo una proteína clave (la proteasa similar a la papaína, o "PLpro") de los enlaces de virus para formar una estructura pareada, o "complejo, "con una proteína humana llamada gen 15 estimulado por interferón (ISG15). PLpro quita ISG15 de otras proteínas celulares humanas para ayudar al SARS-CoV-2 a evadir la respuesta inmune. Comprender cómo interactúan las dos proteínas podría ayudar a desarrollar tratamientos farmacológicos terapéuticos que prevenir su formación y permitir que el sistema inmunológico de una persona luche mejor contra el virus invasor.
Los resultados de la investigación, titulado "Dinámica conformacional en la interacción de la proteasa similar a la papaína del SARS-CoV-2 con la proteína del gen 15 estimulada por interferón humano, "fueron publicados en el Revista de letras de química física .
"En las células humanas que el virus ha infectado, el PLpro del virus SARS-CoV-2 tiende a buscar y unirse con la proteína ISG15, un componente clave de la respuesta inmune de las células, "dijo Hugh O'Neill, líder del grupo de Bioinstalaciones de ORNL y director del Centro de Biología Molecular Estructural del laboratorio. "Cuando PLpro se une a ISG15, hace que el ISG15 cambie de forma. El hallazgo clave es que el ISG15 puede asumir múltiples formas cuando se une a PLpro ".
Usando dispersión de neutrones de ángulo pequeño (SANS) en el reactor de isótopos de alto flujo (HFIR) de ORNL, los investigadores pudieron estudiar los cambios en el complejo mientras ocurrían.
"Mejoramos el contraste entre PLpro e ISG15 preparando PLpro en el que muchos de los átomos de hidrógeno fueron reemplazados por átomos de deuterio, "dijo Kevin Weiss, experto en biodeuteración. "Los neutrones interactúan de manera diferente con los átomos de deuterio, así que esto nos ayudó a diferenciar mejor entre las dos proteínas.
"Usamos neutrones para analizar el complejo en solución, que simula mejor el entorno fisiológico real del cuerpo humano, "dijo Leighton Coates, Gerente de ciencia y tecnología de sistemas de instrumentos para la Segunda Estación de Destino de ORNL. "Esto nos permitió estudiar las formas cambiantes del complejo, que otras técnicas no podrían haber aprendido ".
"La información que obtuvimos de nuestros experimentos aumenta nuestro conocimiento de cómo funciona el virus y nos permitirá construir modelos informáticos más precisos para que los utilicen otros científicos. "dijo Wellington Leite, autor principal e investigador postdoctoral ORNL. "Los investigadores podrán utilizar el modelo para buscar rápidamente sitios en el ISG15 donde se adjunta el PLpro y luego intentar bloquear esos sitios".
Susan Tsutakawa, un científico del personal bioquímico en el Laboratorio Nacional Lawrence Berkeley (Berkeley Lab), obtuvo datos de dispersión de rayos X de ángulo pequeño (SAXS) en el complejo PLpro-ISG15 en el Sincrotrón de fuente de luz avanzada del Laboratorio de Berkeley. "En los estudios de SAXS, podríamos separar diferentes complejos en la muestra acoplando SAXS con cromatografía de exclusión por tamaño y, al mismo tiempo, obtener datos de mayor resolución de la configuración general del complejo, para complementar los estudios SANS que revelaron las conformaciones de los componentes individuales en el complejo, "dijo Tsutakawa.
El equipo planea realizar experimentos adicionales sobre este tipo de complejo biológico para examinar cómo pequeñas moléculas pueden bloquear la unión de PLpro a ISG15.