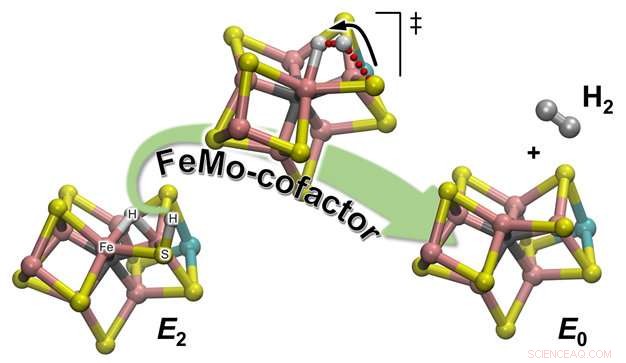
Ilustración esquemática de cómo se forma H2 a partir de uno de los intermedios enzimáticos de reacción (E2) para regenerar el estado de reposo (E0) del cofactor catalítico de nitrogenasa, llamado FeMo-cofactor. El átomo de hidrógeno unido a uno de los átomos de azufre iniciará un viaje que lo llevará al encuentro con el socio con el que formará la molécula de H2:un hidrógeno hidrídico esperando pacientemente, sentado entre dos átomos de Fe. Crédito:Laboratorio Nacional del Noroeste del Pacífico
La nitrogenasa es fundamental para la vida en nuestro planeta. Proporciona la mayor parte del nitrógeno (N) que se utiliza en proteínas y ácidos nucleicos y es esencial para la creación de plantas. animales y otros organismos, haciendo amoníaco (NH3) que luego se usa en la biosíntesis de aminoácidos y luego proteínas. Pero mientras la nitrogenasa está funcionando, también está creando algo más:dihidrógeno (H2). Los científicos saben desde hace algún tiempo que la nitrogenasa produce H2 mediante dos procesos diferentes. Ahora, Uno de estos procesos queda claro a través del trabajo de un equipo de investigadores que estudió el mecanismo de producción de H2.
La nitrogenasa producirá H2 si se ejecuta en ausencia de N2. Esto se ha visto como una "relajación" del sitio activo de la enzima que está cargado con hidruros de hierro que son necesarios para la reacción de reducción de N2. Pero, ¿cuál es el mecanismo por el cual los hidruros de hierro del sitio activo de la nitrogenasa se relajaron para producir este H2? Un equipo de científicos del Laboratorio Nacional del Noroeste del Pacífico, Universidad Estatal de Utah, Northwestern University, y la Universidad de Utah trató de comprender este mecanismo de relajación de H2 mediante el seguimiento de los efectos del hidrógeno (H) frente al deuterio (D) en la cinética de la formación de H2 cuando la nitrogenasa se une a un electrodo. El equipo descubrió que un H + cercano era en realidad el socio activo en la producción de H2 cuando se combina con el hidruro de hierro para producir H2.
"Solo un protón hace todo, el hidruro es solo un mero espectador esperando alguna acción, "confirmó Simone Raugei, un científico de la PNNL involucrado en este trabajo.
Este es un paso importante hacia la comprensión de la nitrogenasa y cómo y por qué se requiere la producción de H2 para su actividad. También ilustra una estrategia para el estudio mecanicista que se puede aplicar a otras enzimas oxidorreductasa y a complejos biomiméticos.
Para aislar la cinética de la producción de hidrógeno, un equipo dirigido por Lance Seefeldt, Brian Hoffman, Shelley Minteer, y Simone Raugei utilizaron pequeñas moléculas para transportar rápidamente electrones desde un electrodo a la mitad catalítica de la nitrogenasa. Seguir las reacciones de los protones fue una tarea complicada y desafiante, dijo Seefeldt, así que para asegurar la precisión, monitorearon el "inventario" de protones (el número de hidrógenos involucrados en la producción catalítica de H2) realizando mediciones cinéticas de hidrógeno / deuterio.
Los resultados de los experimentos sugirieron que solo un hidrógeno estaba realmente involucrado en el paso limitante de la formación de H2, y no dos como indica la estequiometría de la reacción.
Las observaciones experimentales del equipo se confirmaron a través de la química computacional, que proporcionó una descripción atomística detallada del mecanismo de reacción. Hay 2 tipos de hidrógenos en el cofactor catalítico (llamado FeMo-co):uno ubicado en una posición de puente donde se une a dos átomos de hierro (un hidruro de puente), y uno en ligandos de un átomo de azufre cercano (básicamente un átomo de azufre protonado:S-H). Resulta que durante la evolución de H2, este último es el socio activo. El enlace S-H se rompe y el H + resultante se mueve hacia el hidruro puente y lo protona formando H2:Los cálculos proporcionan una explicación de la observación experimental de que solo un hidrógeno está "activo, mientras que el otro es un mero espectador esperando la llegada de su compañero.
"El nivel de acuerdo entre las observaciones y los resultados de la química computacional fue notablemente alto, "dijo Raugei.
Este trabajo es un paso crítico hacia una comprensión mecanicista de la enzima nitrogenasa. Todavía queda trabajo por hacer para comprender el mecanismo del otro proceso de evolución de H2 que conduce a la unión de N2, activación, y reducción a NH3.