Este hongo está lleno de sorpresas:el hongo Jack-o’-lantern brilla en la oscuridad y produce péptidos que podrían ser útiles para los humanos. Crédito:Noah Siegel, wikicommons, CC BY-SA 3.0
Los microbiólogos de ETH dirigidos por Markus Künzler han descubierto una enzima notable en un hongo. Ahora quieren usarlo para desarrollar nuevos medicamentos.
Los hongos parecen ofrecer una reserva verdaderamente inagotable de nuevas sustancias. Uno de esos hongos es el hongo Jack-o'-lantern (Omphalotus olearius), que se encuentra en toda la región mediterránea y tiene un cuerpo fructífero que brilla en la oscuridad.
Pero no es este efecto especial lo que ha interesado a los investigadores médicos; es una enzima descubierta recientemente por investigadores de ETH dirigidos por el microbiólogo Markus Künzler.
Esta enzima, OphA, forma una parte clave de una vía metabólica que mantiene a las plagas alejadas del hongo Jack-o'-lantern. "Los hongos se protegen de los depredadores y competidores utilizando un cóctel de toxinas, muchos de los cuales son proteínas o péptidos, "dice Künzler.
El hongo Jack-o'-lantern utiliza la enzima OphA para proporcionar la columna vertebral de uno de estos péptidos con grupos metilo adicionales. Solo tras esta alteración química y la posterior ciclación, el péptido, onfalotina A, funciona como una toxina. El hongo lo usa para protegerse de plagas como los gusanos redondos.
Una línea de producción difícil de manipular
Los péptidos fúngicos también sirven como fármacos en medicina. Uno de los más conocidos es la ciclosporina A, que se ha utilizado en trasplantes de órganos, enfermedades autoinmunes y medicina contra el cáncer durante casi 40 años.
Este péptido lleva grupos metilo en su columna vertebral como onfalotina A. La forma del anillo y los grupos metilo son responsables de las ventajosas características farmacológicas de la ciclosporina A, en particular, su disponibilidad oral, factor que en la actualidad constituye un obstáculo importante para los fármacos basados en péptidos.
A diferencia de la onfalotina A, cuya columna vertebral, como el de la mayoría de proteínas y péptidos en una célula, es producido por el ribosoma, La ciclosporina A se construye a partir de aminoácidos por una enorme enzima dedicada a esta tarea. Esta enzima funciona de manera muy similar a una línea de producción en la industria automotriz. "Sin embargo, es difícil alterar biotecnológicamente esta línea de producción para producir variantes de ciclosporina A, "dice Künzler.
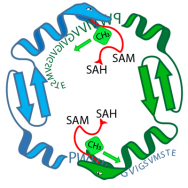
La enzima OphA (serpientes verdes y azules) equipa un péptido precursor de la onfalotina A (secuencia de letras) con grupos metilo. Durante esta fase, la enzima y el péptido están unidos. Crédito:Niels van der Velden, Mike Freeman / ETH Zúrich
Creación de nuevos péptidos en forma de anillo.
Usando la enzima OphA, sin embargo, podría ser posible crear nuevos péptidos en forma de anillo en lugar de simplemente variantes de onfalotina A. Gracias a los grupos metilo unidos a ellos, estos nuevos péptidos poseerían características farmacológicas igualmente ventajosas a las de la ciclosporina A.
Esta posibilidad se debe al hecho de que los péptidos modificados por OphA se producen ribosómicamente y, por tanto, pueden alterarse fácilmente mediante cambios en los genes que codifican el péptido. Además, OphA parece ser menos selectivo sobre los péptidos que puede alterar químicamente. Por lo tanto, la enzima puede unir grupos metilo a una amplia gama de péptidos diferentes.
"Podemos producir péptidos de partida biotecnológicamente diferentes y alterarlos usando OphA, lo que puede permitirnos crear péptidos completamente nuevos con características farmacológicamente ventajosas, "explica Künzler.
OphA permite así la producción de bibliotecas de péptidos en forma de anillo con grupos metilo como base para el desarrollo de fármacos peptídicos. Estas bibliotecas de péptidos se podrían cribar en busca de péptidos que muestren una característica biológica deseada, como la capacidad de unirse a una proteína diana en la terapia del cáncer.
Debido a los grupos metilo adjuntos, los péptidos identificados de esta manera tienen una alta probabilidad de manifestar características farmacológicas ventajosas. Esto significa que representan péptidos líderes prometedores para el desarrollo de sus respectivas terapias peptídicas. "Este enfoque ofrece claras ventajas con respecto a la rentabilidad y la probabilidad de éxito en comparación con los enfoques en los que los grupos metilo solo se introducen en el péptido después, "dice el microbiólogo.
ETH Zurich ha solicitado una patente para el uso de OphA y enzimas relacionadas para insertar grupos metilo en péptidos ribosomales y para el procedimiento utilizado para crear bibliotecas de péptidos correspondientes. Künzler ha recibido una beca CTI, actualmente sin un socio de la industria, para proporcionar la prueba de principio de que la tecnología funciona. También se está discutiendo una escisión. "Sin embargo, tenemos que proporcionar la prueba del concepto de la tecnología antes de que podamos comenzar a recaudar fondos para una posible escisión ". Los próximos dos años probablemente harán o deshacerán este plan.
Expertos entusiastas
Los resultados de Künzler han sido recibidos con entusiasmo entre los expertos en la materia. El interés en su sistema fue alto en una conferencia reciente sobre péptidos en Canadá, y una empresa también ha expresado interés en adquirir una licencia sobre la patente. "Es divertido orientar la investigación fundamental hacia aplicaciones prácticas, "dice Künzler.
Él cree que los hongos tienen el potencial de proporcionar una amplia gama de agentes naturales. Hay millones de diferentes especies de hongos, y el número de sustancias naturales prometedoras es correspondientemente grande. Sin embargo, sigue siendo realista y reconoce que solo una pequeña fracción de estos serán aplicables como drogas. Quizás algunos de los de su colección de péptidos estén entre ellos.