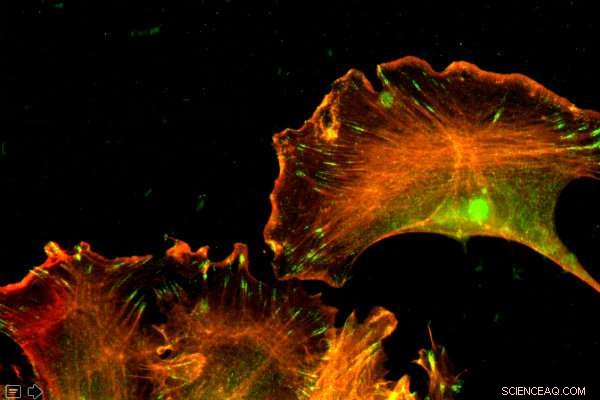
La actina es una proteína abundante, presente en cada celda. Los investigadores de Penn Vet demostraron que las diferencias en el orden de los nucleótidos, no de los aminoácidos, gobernaban las distintas funciones de dos formas de actina. Crédito:Universidad de Pensilvania
Los seres humanos poseen seis formas de la proteína actina, que realizan funciones esenciales en el cuerpo. Dos en particular, β-actina y γ-actina, son casi idénticos, solo difieren en cuatro aminoácidos. Sin embargo, estas proteínas casi gemelas desempeñan funciones distintas. Una pregunta de larga data para los biólogos ha sido:¿Cómo es esto posible?
"Es un misterio que se ha debatido sobre el terreno durante los últimos 40 años, "dijo Anna Kashina, profesor de bioquímica en la Facultad de Medicina Veterinaria de la Universidad de Pensilvania.
Los nuevos hallazgos de Kashina y sus colegas apuntan a una respuesta sorprendente. Las diferentes funciones de estas proteínas no están determinadas por sus secuencias de aminoácidos sino por su código genético.
"Nos gusta llamarlo el 'código silencioso, ", Dijo Kashina." Nuestros hallazgos muestran que las partes de los genes que pensamos que son silenciosas en realidad codifican información funcional muy clave ".
Los investigadores encontraron que estas diferencias "silenciosas" en la secuencia de nucleótidos parecen influir en la densidad de los ribosomas, las máquinas moleculares que traducen el ARN en proteínas. Estas diferencias pueden permitir que cada forma de actina individual asuma un papel diferente en la célula.
Kashina fue coautora del trabajo, publicado en la revista eLife , con Pavan Vedula de Penn Vet, Satoshi Kurosaka, Nicolae Adrian Leu, Junling Wang, Stephanie Sterling y Dawei Dong y Yuri I. Wolf y Svetlana A. Shabalina de los Institutos Nacionales de Salud.
La actina es tan omnipresente y esencial que se la conoce como una "proteína de mantenimiento". Es la proteína más abundante en la mayoría de las células. y sus diferentes formas juegan un papel durante la migración celular, contracción y desarrollo muscular. Por un tiempo, los científicos pensaban que las diferentes formas eran funcionalmente redundantes, existiendo solo para servir como respaldo en caso de que un formulario tuviera un defecto.
Más recientemente, los investigadores han llegado a comprender que las formas no son redundantes; algunos se localizan en diferentes partes de las células, algunos se incorporan en diferentes partes del citoesqueleto. Y cuando estas proteínas son manipuladas, los resultados también son diferentes.
Cuando falta la β-actina, por ejemplo, los ratones mueren en una etapa temprana del desarrollo embrionario. Pero los ratones que carecen de γ-actina, aunque típicamente más pequeño de lo normal y sordo, puede sobrevivir hasta la edad adulta.
En un informe de 2010 en Science, El grupo de Kashina dio un paso hacia la comprensión de lo que determina estas diferencias. Al observar una modificación de una proteína que normalmente solo existe en la β-actina, encontraron que la razón por la que no estaba presente también en la γ-actina se debía a variaciones en la secuencia de codificación entre los dos genes de actina.
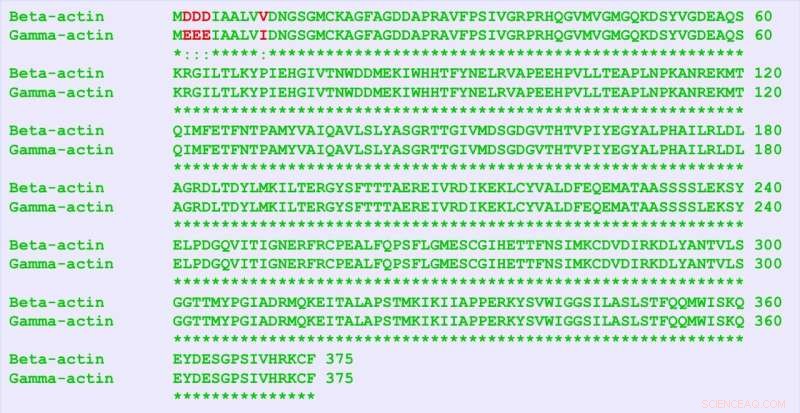
La β-actina y la γ-actina son proteínas casi idénticas, difieren en sólo cuatro aminoácidos (en rojo). Pero contienen muchas más diferencias en su secuencia de nucleótidos, y este "código silencioso" es responsable de funciones distintas de las dos proteínas, los investigadores encontraron. Crédito:Universidad de Pensilvania
"Queríamos aprovechar esto, "Kashina dijo, "y decidió probar la hipótesis, «¿Y si sus diferencias funcionales no tuvieran nada que ver con su secuencia de aminoácidos? ¿y si todo está en los genes? '"
Los investigadores aprovecharon la edición de genes de precisión que hizo posible el sistema CRISPR / Cas-9. Si bien las dos isoformas de actina difieren solo en cuatro aminoácidos, sus secuencias codificantes de ARNm difieren en casi un 13 por ciento debido a diferencias de nucleótidos "silenciosos" que, no obstante, codifican los mismos aminoácidos. Haciendo cambios en solo cinco nucleótidos en el gen de la β-actina, pudieron transformarlo para que su producción de aminoácidos fuera exactamente la misma que la de la proteína γ-actina. Todo lo que lo distinguiría serían las sustituciones silenciosas de nucleótidos.
La edición genética funcionó. Los ratones con estas ediciones no tenían proteína β-actina. Pero a diferencia de los verdaderos knockouts de β-actina, eran completamente saludables y viables, como si poseyeran las proporciones adecuadas de proteínas β-actina y γ-actina. Sobrevivieron para reproducirse y promediaron los mismos tamaños de camada que los animales normales.
Los investigadores realizaron el mismo experimento, editar el gen de γ-actina para codificar la proteína β-actina, pero solo pudieron cambiar la secuencia codificante de tres de los cuatro aminoácidos. Todavía, Los ratones sujetos a este reemplazo parcial también parecían normales y sanos, a pesar de carecer de la proteína γ-actina.
En experimentos de seguimiento, El equipo de Kashina descubrió que las proteínas de γ-actina elaboradas a partir del gen de β-actina editado formaban un citoesqueleto normal y permitían que la célula migrara de manera normal.
"Si solo la secuencia de nucleótidos es importante para la función de las proteínas, entonces a los ratones no les debería importar la proteína que tengan, ", Dijo Kashina." Y a los ratones no les importó ".
Llegar a un mecanismo de cómo la secuencia de ADN podría influir en la función de las proteínas, los investigadores encontraron que la densidad de los ribosomas en el ARN de β-actina es más de mil veces mayor que en el ARN de γ-actina, y de hecho, los seis genes de actina tenían diferencias en la densidad de los ribosomas.
"Esto sugiere que la β-actina podría traducirse en proteína quizás mil veces más rápido que la γ-actina, "Dijo Kashina.
Y curioso por saber cuán extendido podría estar este fenómeno, los investigadores buscaron familias de proteínas con miembros casi idénticos codificados por diferentes genes y que tuvieran variaciones significativas en la densidad de ribosomas en toda la familia. Encontraron muchos grupos que se compartían entre ratones, pez cebra y genomas humanos.
"Creemos que esta forma de regulación funcional es un fenómeno global, "Kashina dijo, y es uno que su laboratorio seguirá investigando.