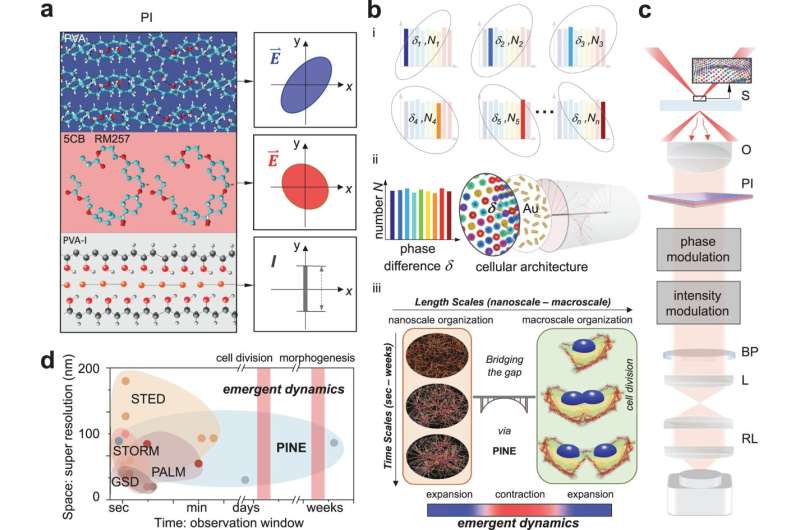
Una nueva forma de ver detalles de menos de la mitad de la longitud de onda de la luz ha revelado cómo el andamiaje a nanoescala dentro de las células conecta con la macroescala durante la división celular. A diferencia de las técnicas de superresolución anteriores, la desarrollada y probada en la Universidad de Michigan no se basa en moléculas que se desgastan con el uso prolongado.
La superresolución puede revelar estructuras de hasta 10 nanómetros, o aproximadamente la misma amplitud que 100 átomos. Abrió un mundo completamente nuevo en biología, y las técnicas que lo hicieron posible recibieron el Premio Nobel en 2014. Sin embargo, su debilidad es que solo puede tomar instantáneas en decenas de segundos. Esto hace imposible observar la evolución de la maquinaria de una célula durante largos períodos de tiempo.
"Nos preguntábamos:cuando el sistema en su conjunto se está dividiendo, ¿cómo interactúan las estructuras a escala nanométrica con sus vecinas a escala nanométrica y cómo se amplía esta interacción a toda la célula?" preguntó Somin Lee, profesor asistente de ingeniería eléctrica e informática de la UM, quien dirigió el estudio publicado en Nature Communications. .
Para responder a esa pregunta, Lee y sus colegas necesitaban un nuevo tipo de superresolución. Usando su nuevo método, pudieron monitorear continuamente una celda durante 250 horas.
"La célula viva es un lugar ajetreado con proteínas bullendo aquí y allá. Nuestra superresolución es muy atractiva para observar estas actividades dinámicas", dijo Guangjie Cui, Ph.D. estudiante de ingeniería eléctrica e informática y coprimer autor del estudio con Yunbo Liu, Ph.D. Licenciado en ingeniería eléctrica e informática.
Al igual que el método original, la nueva técnica utiliza sondas cerca de los objetos de interés a nanoescala para arrojar luz sobre ellos. Superresolución 1.0 utilizó para esto fluoróforos, moléculas fluorescentes que enviarían una luz de respuesta después de ser iluminadas. Si los fluoróforos estuvieran más juntos que el tamaño de lo que se estaba fotografiando, la imagen podría reconstruirse a partir de los estallidos de luz producidos por los fluoróforos.
La nueva técnica utiliza nanobarras de oro, que no se rompen con la exposición repetida a la luz, pero hacer uso de la luz que interactúa con ellas es más desafiante. Los nanorods responden a la fase de la luz, o dónde se encuentra en la oscilación hacia arriba y hacia abajo de los campos eléctricos y magnéticos que la componen. Esta interacción depende del ángulo del nanorod con respecto a la luz entrante.
Al igual que los fluoróforos, las nanobarras pueden unirse a estructuras celulares particulares con moléculas objetivo en sus superficies. En este caso, los nanorods buscaron actina, una proteína que añade estructura a las células blandas. La actina tiene forma de filamentos ramificados, cada uno de unos 7 nanómetros (millonésimas de milímetro) de diámetro, aunque se unen para abarcar miles de nanómetros. Aunque las nanobarras suelen tener más del doble del diámetro de la actina, los datos que proporcionan como grupo pueden iluminar sus pequeños detalles.
Para localizar las nanobarras, el equipo construyó filtros hechos de finas capas de polímeros y cristales líquidos. Estos filtros permitieron la detección de luz con una fase particular, lo que permitió al equipo seleccionar nanobarras con ángulos particulares con respecto a la luz entrante. Al tomar entre 10 y 30 imágenes (cada una de las cuales observaba un subconjunto diferente de nanobarras) y fusionarlas en una sola imagen, el equipo pudo deducir los detalles a escala nanométrica de los filamentos dentro de las células. Estos detalles quedarían borrosos en los microscopios convencionales.
Utilizando esta técnica, el equipo descubrió tres reglas que rigen la forma en que la actina se autoorganiza durante la división celular:
El comportamiento de la actina está relacionado con el comportamiento de la célula, pero la célula se contrae cuando la actina se expande y se expande cuando la actina se contrae. El equipo quiere explorar esto más a fondo, descubriendo por qué los movimientos son opuestos en diferentes escalas. También quieren investigar las consecuencias de la desregulación de este proceso molecular:¿es esto la raíz de algunas enfermedades?
En términos más generales, esperan utilizar la superresolución para comprender cómo se construye la autoorganización en las estructuras biológicas, sin la necesidad de un control central.
"Nuestro código genético en realidad no incluye suficiente información para codificar cada detalle del proceso de organización", dijo Lee. "Queremos explorar los mecanismos de comportamientos colectivos sin coordinación central, que son como pájaros volando en formación, en los que el sistema es impulsado por interacciones entre partes individuales".
Más información: Guangjie Cui et al, El nanoscopio de intensidad de fase (PINE) abre ventanas de investigación a largo plazo de la materia viva, Nature Communications (2023). DOI:10.1038/s41467-023-39624-w
Información de la revista: Comunicaciones sobre la naturaleza
Proporcionado por la Universidad de Michigan