Algunas vacunas contra la COVID-19 utilizaron de forma segura y eficaz nanopartículas lipídicas (LNP) para entregar ARN mensajero a las células. Un nuevo estudio del MIT muestra que se podrían utilizar diferentes nanopartículas para una posible terapia contra la enfermedad de Alzheimer (EA). En pruebas en múltiples modelos de ratón y con células humanas cultivadas, una formulación LNP recientemente adaptada entregó eficazmente pequeños ARN de interferencia (ARNip) a las células inmunes de la microglía del cerebro para suprimir la expresión de una proteína relacionada con la inflamación excesiva en la enfermedad de Alzheimer.
En un estudio anterior, los investigadores demostraron que bloquear las consecuencias de la actividad de la proteína PU.1 ayuda a reducir la neuroinflamación y la patología relacionadas con la enfermedad de Alzheimer. Los nuevos resultados, publicados en la revista Advanced Materials , logran una reducción de la inflamación al reducir directamente la expresión del gen Spi1 que codifica PU.1.
En términos más generales, el nuevo estudio también demuestra una nueva forma de administrar ARN a la microglía, que hasta ahora ha sido difícil de abordar.
La coautora principal del estudio, Li-Huei Tsai, profesora Picower de Neurociencia y directora de la Iniciativa Cerebral del Instituto Picower para el Aprendizaje, la Memoria y el Envejecimiento, dijo que planteó la hipótesis de que las LNP podrían funcionar como una forma de llevar ARNip a la microglía porque las células, que limpian Los desechos en el cerebro tienen una fuerte propensión a absorber moléculas de lípidos.
Habló de esto con Robert Langer, profesor del Instituto David Koch, ampliamente conocido por su trabajo fundamental sobre la administración de fármacos con nanopartículas; decidieron probar la idea de reducir la expresión de PU.1 con un ARNip administrado por LNP.
"Todavía recuerdo el día en que pedí reunirme con Bob para discutir la idea de probar las LNP como una carga útil para atacar la microglía inflamatoria", dijo Tsai, miembro de la facultad del Departamento de Ciencias Cognitivas y del Cerebro. "Estoy muy agradecido a la Fundación JPB, que apoyó esta idea sin ninguna evidencia preliminar."
El estudiante graduado de Langer Lab, Jason Andresen, y el ex postdoctorado de Tsai Lab, William Ralvenius, dirigieron el trabajo y son los coautores principales del estudio. Owen Fenton, ex postdoctorado del Langer Lab y ahora profesor asistente en la Facultad de Farmacia Eshelman de la Universidad de Carolina del Norte, es coautor correspondiente junto con Tsai y Langer. Langer es profesor de Ingeniería Química, Ingeniería Biológica y del Instituto Koch para la Investigación Integrativa del Cáncer.
La forma más sencilla de probar si el ARNip podría suprimir terapéuticamente la expresión de PU.1 habría sido utilizar un dispositivo de administración ya disponible, pero uno de los primeros descubrimientos del estudio es que ninguno de los ocho reactivos disponibles comercialmente podría transfectar de forma segura y eficaz cultivos Células humanas similares a la microglía en el laboratorio.
En cambio, el equipo tuvo que optimizar un LNP para realizar el trabajo. Los LNP tienen cuatro componentes principales y, al cambiar las estructuras de dos de ellos y variar la proporción de lípidos a ARN, los investigadores pudieron idear siete formulaciones para probar. Es importante destacar que sus pruebas incluyeron probar sus formulaciones en microglia cultivada que habían inducido a un estado inflamatorio. Ese estado, después de todo, es aquel en el que se necesita el tratamiento propuesto.
Entre los siete candidatos, uno que el equipo llamó "MG-LNP" destacó por su eficiencia de entrega especialmente alta y la seguridad de una carga de ARN de prueba.
Lo que funciona en un plato a veces no funciona en un organismo vivo, por lo que el equipo probó a continuación la eficacia y seguridad de sus formulaciones de LNP en ratones. Al probar dos métodos diferentes de inyección, en el cuerpo o en el líquido cefalorraquídeo (LCR), descubrieron que la inyección en el LCR garantizaba una eficacia mucho mayor para atacar la microglía sin afectar las células de otros órganos.
Entre las siete formulaciones, MG-LNP volvió a demostrar ser la más eficaz para transfectar la microglía. Langer dijo que cree que esto podría abrir algún día nuevas formas de tratar ciertas enfermedades cerebrales con nanopartículas.
Una vez que supieron que MG-LNP podría entregar una carga de prueba a la microglía tanto en cultivos de células humanas como en ratones, los científicos probaron si usarlo para administrar un ARNip supresor de PU.1 podría reducir la inflamación en la microglía. En los cultivos celulares, una dosis relativamente baja logró una reducción del 42 por ciento de la expresión de PU.1 (lo cual es bueno porque la microglía necesita al menos algo de PU.1 para vivir).
De hecho, la transfección con MG-LNP no causó ningún daño a las células. También redujo significativamente la transcripción de los genes que aumentan la expresión de PU.1 en la microglía, lo que indica que puede reducir múltiples marcadores inflamatorios.
En todas estas medidas y otras, MG-LNP superó a un reactivo disponible comercialmente llamado RNAiMAX que los científicos probaron en paralelo.
"Estos hallazgos respaldan el uso de la administración de ARNip anti-PU.1 mediada por MG-LNP como una terapia potencial para las enfermedades neuroinflamatorias", escribieron los investigadores.
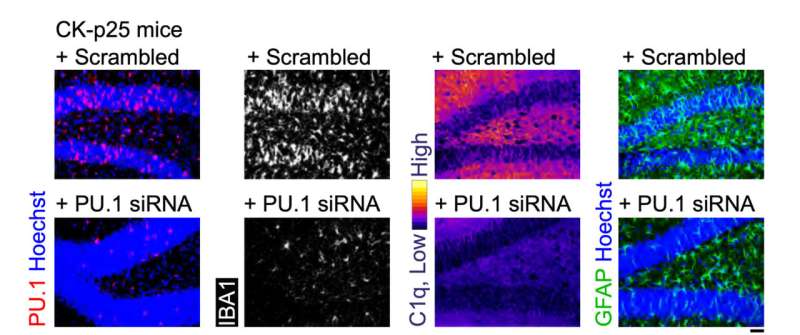
El conjunto final de pruebas evaluó el desempeño de MG-LNP, administrando el ARNip en dos modelos de inflamación en el cerebro en ratones. En uno, los ratones fueron expuestos a LPS, una molécula que simula la infección y estimula una respuesta de inflamación sistémica. En el otro modelo, los ratones presentan neurodegeneración e inflamación graves cuando una enzima llamada CDK5 se hiperactiva por una proteína llamada p25.
En ambos modelos, la inyección de MG-LNP que portan el ARNip anti-PU.1 redujo la expresión de PU.1 y de marcadores inflamatorios, de forma muy parecida a lo que ocurre en células humanas cultivadas.
"La administración MG-LNP de ARNip anti-PU.1 puede usarse potencialmente como un tratamiento antiinflamatorio en ratones con inflamación sistémica y en el modelo de ratón CK-p25 de neuroinflamación similar a la EA", concluyeron los científicos, calificando los resultados como una "prueba de principio". Se necesitarán más pruebas antes de que la idea pueda probarse en pacientes humanos.
Más información: William T. Ralvenius et al, La administración mediada por nanopartículas de ARNip anti-PU.1 mediante administración intracisternal localizada reduce la neuroinflamación, Materiales avanzados (2023). DOI:10.1002/adma.202309225
Información de la revista: Materiales avanzados
Proporcionado por el Instituto de Tecnología de Massachusetts