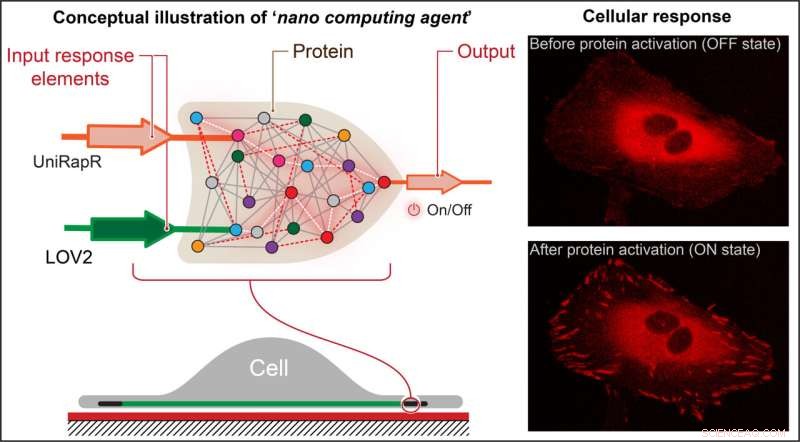
Los investigadores crearon una "puerta lógica" similar a un transistor, que es un tipo de operación computacional en la que múltiples entradas controlan una salida, y la incrustaron en una proteína. Descubrieron que no solo podían activar rápidamente la proteína usando la luz y el fármaco rapamicina, sino también que esta activación provocó que las células sufrieran cambios internos que mejoraron sus capacidades adhesivas, lo que finalmente disminuyó su motilidad. Crédito:Penn State
La creación de computadoras a nanoescala para su uso en la atención médica de precisión ha sido durante mucho tiempo un sueño de muchos científicos y proveedores de atención médica. Ahora, por primera vez, los investigadores de Penn State han producido un agente de nanocomputación que puede controlar la función de una proteína particular que está involucrada en el movimiento celular y la metástasis del cáncer. La investigación allana el camino para la construcción de computadoras complejas a nanoescala para la prevención y el tratamiento del cáncer y otras enfermedades.
Nikolay Dokholyan, profesor G. Thomas Passananti, Penn State College of Medicine, y sus colegas, incluido Yashavantha Vishweshwaraiah, becario postdoctoral en farmacología, Penn State, crearon una "puerta lógica" similar a un transistor, que es un tipo de operación computacional en la que múltiples entradas controlan una salida.
"Nuestra puerta lógica es solo el comienzo de lo que podría llamarse computación celular", dijo, "pero es un hito importante porque demuestra la capacidad de incorporar operaciones condicionales en una proteína y controlar su función", dijo Dokholyan. nos permite obtener una comprensión más profunda de la biología y las enfermedades humanas e introduce posibilidades para el desarrollo de terapias de precisión".
La puerta lógica del equipo constaba de dos dominios sensores diseñados para responder a dos entradas:la luz y el fármaco rapamicina. El equipo se centró en la proteína quinasa de adhesión focal (FAK) porque está involucrada en la adhesión y el movimiento celular, que son los pasos iniciales en el desarrollo del cáncer metastásico.
"Primero, introdujimos un dominio sensible a la rapamicina, llamado uniRapr, que el laboratorio había diseñado y estudiado previamente, en el gen que codifica FAK", dijo Vishweshwaraiah. "Luego, presentamos el dominio, LOV2, que es sensible a la luz. Una vez que optimizamos ambos dominios, los combinamos en un diseño de puerta lógica final".
El equipo insertó el gen modificado en células cancerosas HeLa y, mediante microscopía confocal, observó las células in vitro. Estudiaron los efectos de cada una de las entradas por separado, así como los efectos combinados de las entradas, en el comportamiento de las células.
Descubrieron que no solo podían activar FAK rápidamente usando luz y rapamicina, sino también que esta activación provocaba cambios internos en las células que aumentaban sus capacidades adhesivas, lo que en última instancia disminuía su motilidad.
Sus resultados publicados hoy (16 de noviembre) en la revista Nature Communications .
"Mostramos por primera vez que podemos construir un agente de nanocomputación funcional dentro de las células vivas que puede controlar el comportamiento celular", dijo Vishweshwaraiah. "También descubrimos algunas características interesantes de la proteína FAK, como los cambios que desencadena en las células cuando se activa".
Dokholyan señaló que el equipo espera eventualmente probar estos agentes de nanocomputación in vivo dentro de organismos vivos.
Otros autores de Penn State en el artículo incluyen a Jiaxing Chen, estudiante de posgrado; Venkat R. Chirasani, becario postdoctoral; y Erdem D. Tabdanov, profesor asistente de farmacología. Convertir células en computadoras con puertas lógicas de proteínas