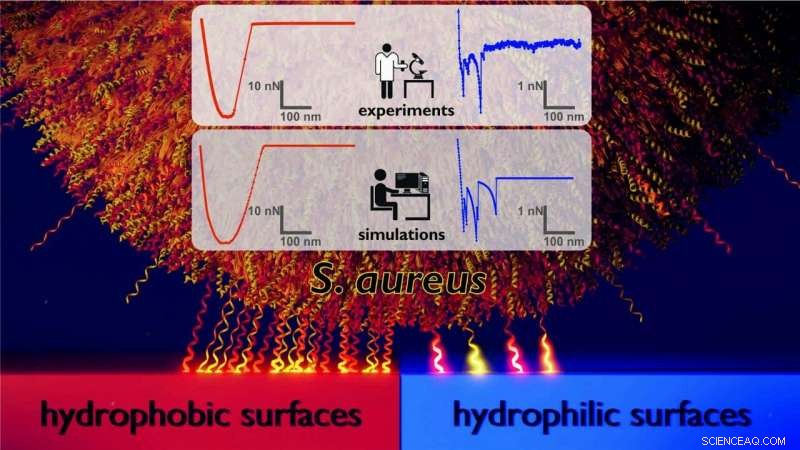
Modelo del mecanismo de adhesión por el cual la bacteria Staphylococcus aureus se une a superficies hidrofóbicas ('de baja energía') (izquierda) en comparación con superficies hidrofílicas (de 'alta energía') (derecha). A la izquierda, una gran cantidad de moléculas de la pared celular (mostradas aquí como pequeños resortes comprimibles) están involucradas en unir la célula a la superficie hidrófoba. En la superficie hidrofílica que se muestra a la derecha, hay muchas menos moléculas involucradas. Los resultados fueron obtenidos por un equipo de físicos experimentales y teóricos de la Universidad de Saarland que realizaron simulaciones computacionales de Monte Carlo de datos de fuerza-distancia de experimentos de microscopía de fuerza atómica. Crédito:Universidad de Saarland
Los resultados de estudios tanto en física experimental como teórica pueden ayudar a mejorar las superficies antibacterianas. El trabajo de investigación fue publicado recientemente en la revista Nanoescala .
Staphylococcus aureus Las bacterias son una de las causas más comunes de infecciones adquiridas por los pacientes durante su estancia en el hospital. Estos patógenos son particularmente problemáticos porque pueden formar biopelículas robustas tanto en superficies naturales como artificiales de las que son muy difíciles de eliminar. "Las bacterias individuales dentro de estas biopelículas están protegidas eficazmente del ataque de antibióticos o del sistema inmunológico humano. Es por eso que puede ser tan peligroso cuando estas bacterias colonizan implantes médicos, ya que pueden causar infecciones posoperatorias graves". "explica Karin Jacobs, Catedrático de Física Experimental en la Universidad de Saarland. Por lo tanto, es crucial intentar evitar que se formen estas biopelículas en primer lugar.
Sin embargo, poder influir en el crecimiento de la biopelícula, los investigadores debían comprender los mecanismos por los que las bacterias se adhieren a diferentes materiales. Usando un microscopio de fuerza atómica de barrido, presionaron las diminutas células bacterianas sobre diferentes tipos de superficies y luego determinaron la fuerza necesaria para levantar las células adheridas de la superficie. Esta configuración experimental permitió a los investigadores registrar lo que se conoce como curvas de fuerza-distancia. "Utilizamos superficies de silicio extremadamente lisas como superficies modelo. En un conjunto de experimentos, las superficies de silicio se prepararon para que tuvieran una alta humectabilidad con agua; en otra serie de experimentos se les trató como altamente hidrófobos. Pudimos demostrar que las células bacterianas se adhirieron mucho más fuertemente a las superficies hidrofóbicas, del cual el agua simplemente se desprendió, que en las superficies hidrófilas (humectables con agua), "explica Karin Jacobs.
Pero no es solo la magnitud de las fuerzas lo que difiere entre los dos tipos de superficies, también lo hacen las formas de las curvas fuerza-distancia (ver figura). "En las superficies hidrofóbicas, vemos curvas muy suaves con una característica forma de copa. En las superficies hidrofílicas, a diferencia de, observamos curvas de fuerza-distancia con un perfil muy irregular, "dice el profesor Jacobs.
Para comprender estos resultados, la dinámica de estos complejos sistemas se modeló mediante simulaciones de Monte Carlo que se llevaron a cabo en el grupo de investigación liderado por el profesor Ludger Santen, Catedrático de Física Teórica en la Universidad de Saarland. El modelo trata la célula bacteriana como una esfera rígida y las moléculas de la pared celular que unen la célula a la superficie como resortes diminutos. "Resulta que para reproducir los resultados experimentales, el papel que juega la naturaleza aleatoria (estocástica) del proceso de unión molecular es más importante que intentar aumentar la complejidad del modelo. Ahora hemos descubierto por qué las células bacterianas se comportan de manera tan diferente en diferentes tipos de superficies. En superficies hidrofóbicas, una gran cantidad de proteínas de la pared celular se adhieren a la superficie, lo que da como resultado una fuerte fuerza de unión y produce una curva suave de fuerza-distancia, "explica Ludger Santen.
A diferencia de, sobre una superficie hidrofílica, muchas menos proteínas de la pared celular están involucradas en unir la bacteria a la superficie. Como resultado, las bacterias se mantienen con menos fuerza en la superficie y la forma de la curva fuerza-distancia es menos uniforme. "La forma irregular de las curvas que vemos con las superficies hidrófilas es causada por unas pocas moléculas individuales de la pared celular a medida que se extraen de la superficie. Debido a que están involucradas menos proteínas de la pared celular, las bacterias se unen con menos fuerza a las superficies hidrofílicas, "dice Erik Maikranz, quien realizó las simulaciones de Monte Carlo como parte de su trabajo de investigación doctoral.
Debido a las diferentes formas de las curvas fuerza-distancia, los físicos suponen que en una superficie hidrófila hay menos proteínas de la pared celular involucradas en el proceso de unión porque estas moléculas primero tienen que superar una barrera potencial, lo que reduce efectivamente el número de macromoléculas de proteínas que pueden unir la célula a la superficie. "La barrera potencial para la adhesión en superficies hidrófilas es relativamente alta, por lo que solo unas pocas de las proteínas de la pared celular pueden superar esta barrera energética en un momento determinado. En superficies hidrofóbicas, sin embargo, la barrera es insignificante, para que muchas proteínas de la pared celular puedan adherirse directamente a la superficie, "explica el Dr. Christian Spengler, quien realizó los experimentos en el estudio.