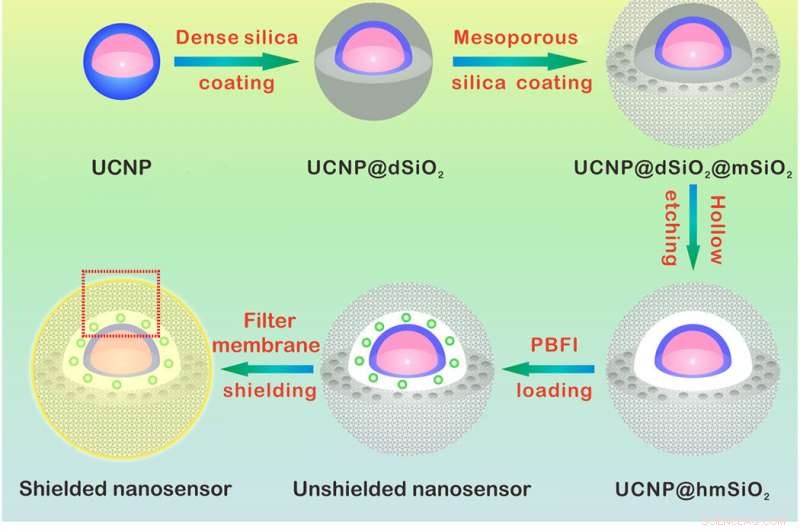
Diseño y mecanismo de detección del nanosensor de K +. (A) Ilustración esquemática para la síntesis del nanosensor. El núcleo de NaYF4:Yb / Tm @ NaYF4:Yb / Nd (UCNP) se sintetizó y revistió con una capa de sílice densa y una sucesiva capa de sílice mesoporosa. El grabado de la densa capa de sílice forma una cavidad hueca que permite la carga de PBFI. El nanosensor se revistió finalmente con la membrana de filtro selectivo de K +. (B) Esquemas que muestran una vista ampliada del nanosensor [del cuadro punteado rojo en (A)] y su mecanismo de detección de K +. La capa de la membrana del filtro permite que solo el K + se difunda dentro y fuera del nanosensor, excluyendo así la interferencia de otros cationes. Una vez difundido en el nanosensor, K + se unirá a PBFI inmediatamente. Tras la irradiación NIR, la luz ultravioleta convertida hacia arriba de los UCNP excita a PBFI, que conduce a la emisión de PBFI enlazado con K +. Crédito:Science Advances, doi:10.1126 / sciadv.aax9757
Los investigadores han desarrollado una serie de iones potasio (K + ) sondas para detectar fluctuaciones de K + concentraciones durante una variedad de procesos biológicos. Sin embargo, tales sondas no son lo suficientemente sensibles para detectar fluctuaciones fisiológicas en animales vivos y no es fácil monitorear tejidos profundos con excitaciones de longitud de onda corta que están en uso hasta ahora. En un nuevo informe, Jianan Liu y un equipo de investigadores en neurociencia, química, e ingeniería molecular en China, describir un nanosensor altamente sensible y selectivo para infrarrojo cercano (NIR) K + imágenes de iones en células vivas y animales. El equipo construyó el nanosensor encapsulando nanopartículas de conversión ascendente (UCNP) y un indicador comercial de iones de potasio en la cavidad hueca de nanopartículas de sílice mesoporosas y las recubrió con una K + Membrana filtrante selectiva. La membrana adsorbió K + del medio y filtrar los cationes que interfieren. En su mecanismo de acción, Los UCNP convirtieron NIR en luz ultravioleta (UV) para excitar el indicador de iones de potasio y detectar concentraciones fluctuantes de iones de potasio en células cultivadas y en modelos animales de enfermedad, incluidos ratones y larvas de pez cebra. Los resultados ahora se publican en Avances de la ciencia .
El catión potasio intracelular más abundante (K + ) es extremadamente crucial en una variedad de procesos biológicos, incluida la transmisión neuronal, latido del corazón, contracción muscular y función renal. Variaciones en el K intracelular o extracelular + concentración (referida aquí como [K + ]) sugieren funciones fisiológicas anormales, incluida la disfunción cardíaca, cáncer, y diabetes. Como resultado, Los investigadores están interesados en desarrollar estrategias efectivas para monitorear la dinámica de [K + ] fluctuaciones, específicamente con imágenes ópticas directas.
La mayoría de las sondas existentes no son sensibles a K + detección en condiciones fisiológicas y no puede diferenciar las fluctuaciones entre [K + ] y el ion sodio que lo acompaña ([Na + ]) durante el transporte transmembrana en el Na + / K + zapatillas. Si bien las imágenes de fluorescencia de por vida pueden distinguir K + y Na + en solución de agua, el método requiere instrumentos especializados. La mayoría de K + Los sensores también se activan con luz de longitud de onda corta, incluida la luz ultravioleta (UV) o visible, lo que produce una dispersión significativa y una profundidad de penetración limitada al examinar tejidos vivos. A diferencia de, la técnica de obtención de imágenes de infrarrojo cercano (NIR) propuesta ofrecerá ventajas únicas durante la obtención de imágenes de tejido profundo como una alternativa plausible.
Caracterización estructural del nanosensor de K +. (A a C) Imágenes anulares de campo oscuro de alto ángulo de UCNP @ dSiO2 (A), UCNP @ dSiO2 @ mSiO2 (B), y UCNP @ hmSiO2 (C). (D) Imagen de microscopía electrónica de barrido (SEM) del nanosensor blindado. (E) Imagen SEM del nanosensor blindado sumergido en una solución acuosa que contiene 150 mM de Na +, 150 mM K +, 2 mM Ca2 +, 2 mM de Mg2 +, 50 μM Fe2 +, 2 mM de Zn2 +, 50 μM Mn2 +, y 50 µM de Cu2 +. (F) Los perfiles de barrido de líneas elementales EDS a lo largo de la línea blanca en (E) revelan que solo las señales de K + están presentes en los mesoporos y cavidades huecas de los nanosensores blindados. Crédito:Science Advances, doi:10.1126 / sciadv.aax9757 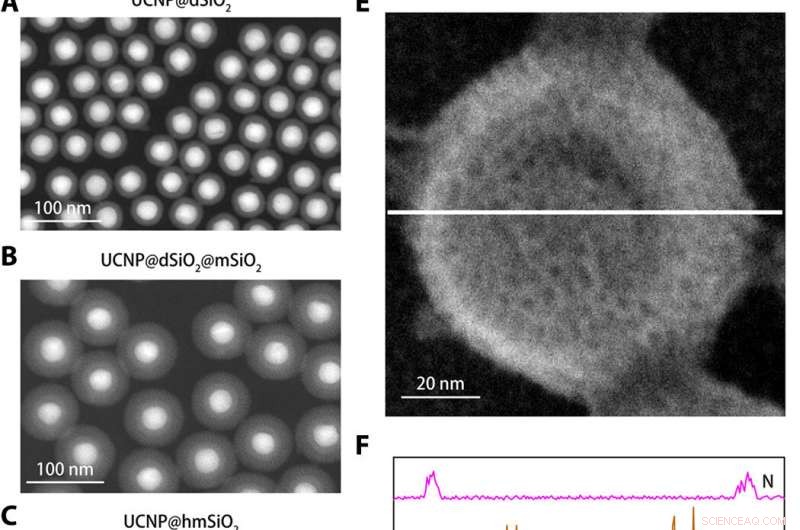
Para diseñar el nanosensor, Liu y col. nanopartículas encapsuladas de conversión ascendente (UCNP) y un K comercial + indicador:isoftalato de benzofurano que se une al potasio (PBFI) en el núcleo de las nanopartículas de sílice mesoporosas (MSN). Los UCNP pudieron convertir la luz NIR en luz ultravioleta y excitar al aceptor de la K + indicador a través de transferencia de energía de resonancia de luminiscencia. Protegieron la superficie exterior de las nanopartículas de sílice con una fina capa de K + Membrana de filtro selectiva con microporos creados a partir de oxígeno carbonilo para mayor especificidad. La configuración favoreció la libre transferencia de K + a través del poro de la membrana, al tiempo que evita que otros cationes biológicamente relevantes se difundan. La técnica les permitió detectar ligeras fluctuaciones en [K + ] en la solución. El equipo utilizó microscopía electrónica de transmisión (TEM) para observar la estructura y el aspecto bien controlados de las nanopartículas durante cada paso de la construcción del nanosensor. La dispersión dinámica de la luz confirmó la presencia de una membrana de filtro en la superficie del nanosensor blindado.
Imágenes del flujo de salida de K + en células HEK 293. (A) Esquemas que muestran la detección de eflujo de K + por un nanosensor conjugado con estreptavidina, que está atado a una célula modificada con biotina. (B) Imágenes de microscopía confocal que muestran la fluorescencia (a 400 a 500 nm y 500 a 600 nm) de células HEK 293 marcadas con nanosensores en diferentes puntos de tiempo después del tratamiento con el estimulador de eflujo de K + (una mezcla de nigericina 5 μM, Bumetanida 5 μM, y ouabaína 10 µM). (C) Cursos de tiempo de las variaciones de fluorescencia del nanosensor y dependencia temporal calculada de la tasa de salida de K + después del tratamiento con estimulador de salida de K +. (D) Fluctuaciones de fluorescencia dependientes del tiempo de células HEK 293 marcadas con nanosensores blindados después de tratamientos con diferentes concentraciones (20, 40, 60, 80, y 100%) de estimulador de eflujo de K +. Los resultados de cinco experimentos independientes se resumieron como media ± SEM en (C) y (D). Crédito:Science Advances, doi:10.1126 / sciadv.aax9757 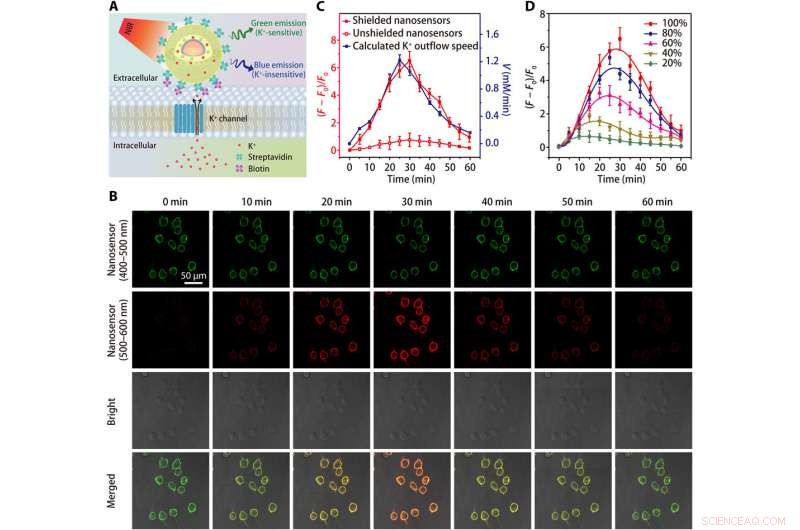
El equipo probó la sensibilidad mejorada del nanosensor blindado en un rango fisiológico (0 a 150 mM) y mostró un aumento de 12 veces en la intensidad de la fluorescencia en comparación con los nanosensores sin blindaje. La K + las sondas tenían que mostrar una alta selectividad contra Na + , que Liu et al. verificado utilizando el nanosensor blindado mediante la detección rápida de una sensibilidad de fluorescencia constante a las fluctuaciones de [K + ], sin verse afectado por el aumento de [Na + ].
Dado que las células vivas dependen de la adenosina trifosfatasa de sodio y potasio (Na + / K + bomba) para mantener una pendiente [K + ] gradiente a través de su membrana plasmática, el proceso es parcialmente responsable del gasto energético de la célula. Los defectos en el metabolismo energético celular pueden provocar una pérdida de [K + ] degradado, dando lugar a extracelulares [K + ] conocido como [K + ] 0, que los científicos monitorearon para obtener un indicador valioso de la viabilidad y el crecimiento celular. Después de eso, aumentaron la especificidad del nanosensor para detectar la muerte celular o las tasas de proliferación mediante el injerto de polietilenglicol (PEG) en la superficie de los nanosensores en un medio de cultivo que contiene la línea celular 293 de riñón embrionario humano. Luego optimizaron el protocolo al anclar una gran cantidad de nanosensores en las membranas celulares utilizando nanosensores conjugados con estreptavidina en células modificadas con biotina. Los resultados destacaron la sensibilidad mejorada de los nanosensores blindados para monitorear continuamente el K + eflujo.
Resultados de imágenes de K + del cerebro de ratón tratado con nanosensores protegidos al iniciar la depresión propagada por activación de KCl. El video de larga duración es ocho veces más rápido que la velocidad real. Crédito:Science Advances, doi:10.1126 / sciadv.aax9757 
Luego, el equipo aplicó el nanosensor blindado para investigar la depresión de propagación cortical (CSD) en el cerebro del ratón como una propagación de la actividad neuronal en forma de onda. El proceso generalmente implica una liberación de propagación lenta de K + en la superficie cortical y podría activarse en el cerebro del ratón mediante la incubación con cloruro de potasio (KCl). Los científicos monitorearon simultáneamente el potencial de campo local y la señal óptica a través de la ventana craneal quirúrgica y observaron una onda de aumento de [K + ] 0 propagarse gradualmente a través de la corteza después de la estimulación. Liu y col. no observó una onda en ratones inyectados con nanosensores sin blindaje, lo que indica la importancia del filtro exterior para mejorar la sensibilidad del nanosensor. La velocidad de onda registrada no varió significativamente de los valores obtenidos utilizando imágenes de resonancia magnética (IRM) dependientes del nivel de oxígeno en sangre en pacientes con aura de migraña.
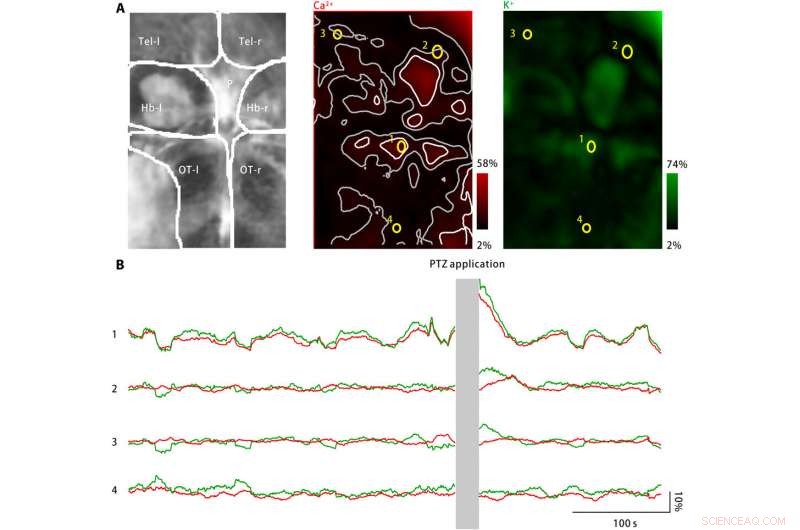
Explosión de potasio extracelular en el cerebro de las larvas de pez cebra tras el tratamiento con PTZ. (A) El tratamiento con PTZ indujo aumentos tanto en la actividad de calcio neuronal (centro) como en la concentración de potasio extracelular (derecha). Izquierda:las áreas del cerebro fotografiadas incluyen el telencéfalo izquierdo y derecho (Tel-l y Tel-r, respectivamente), las habénulas izquierda y derecha (Hb-1 y Hb-r, respectivamente), el cuerpo pineal (P), y la tecta óptica izquierda y derecha (OT-l y OT-r, respectivamente). Medio:la actividad del calcio neuronal se controló mediante el uso de un indicador de calcio expresado genéticamente, jRGECO1a. La amplitud de respuesta medida se codifica en rojo y se asigna de nuevo a la región del cerebro de la imagen. Los puntos de actividad dispersos están marcados en blanco, y sus zonas vecinas están marcadas en gris. Se seleccionan cuatro ROI (amarillo). Derecha:La concentración de potasio extracelular se controló utilizando el nanosensor de potasio. La amplitud de respuesta medida se codifica en verde y se asigna a la región del cerebro de la imagen. (B) La actividad de calcio neuronal (rojo) y las concentraciones de potasio extracelular observadas para las cuatro ROI representativas están marcadas en (A). Después de la aplicación PTZ, tanto la actividad de calcio neuronal como la concentración de potasio extracelular han aumentado en varios puntos de actividad, incluyendo el cuerpo pineal y la tecta óptica anterior, representado por ROI1. En las zonas vecinas de los puntos de actividad, el cambio de la actividad del calcio neuronal está ausente o es mínimo, mientras que la concentración de potasio extracelular sigue aumentando (ROI2 y ROI3). Sin embargo, en la zona alejada de los puntos de actividad (ROI4), no ha aumentado ni la actividad del calcio neuronal ni la concentración extracelular de potasio. Crédito:Science Advances, doi:10.1126 / sciadv.aax9757
Para ampliar las aplicaciones del nanosensor, Liu y col. monitoreó los niveles de calcio neuronal y las concentraciones de potasio extracelular utilizando larvas de pez cebra. Si bien un gran aumento en la concentración de potasio extracelular puede causar una intensa activación neuronal que cause CSD y epilepsia, no existe evidencia directa que muestre cambios en el potasio extracelular durante la enfermedad. Por lo tanto, el equipo diseñó un modelo de enfermedad utilizando larvas de pez cebra para aumentar las concentraciones extracelulares de potasio y observó la activación neuronal característica de la enfermedad en regiones específicas del cerebro.
De este modo, Jianan Liu y sus colegas diseñaron un nanosensor de iones de potasio con una sensibilidad y selectividad extremadamente altas. El revestimiento externo de una membrana de filtro selectivo mejoró la selectividad, sensibilidad, y cinética del dispositivo de forma rápida y cuantitativa [K + ] detección en células vivas y cerebros intactos. El nanosensor blindado tendrá amplias aplicaciones en la investigación del cerebro para mejorar la comprensión de las anomalías [K + ]-enfermedades relacionadas. El método, junto con el endoscopio y la fotometría basados en fibra óptica, permitirá obtener imágenes de potasio en tiempo real en animales que se mueven libremente.
© 2020 Science X Network