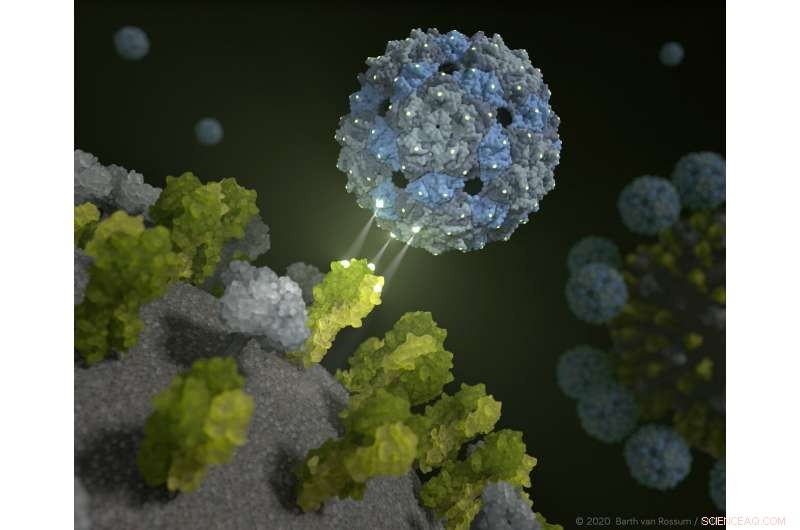
El caparazón del fago se acopla e inhibe el virus de la influenza. Crédito:Barth van Rossum / FMP
Un nuevo enfoque trae la esperanza de nuevas opciones terapéuticas para suprimir la influenza estacional y la gripe aviar. Sobre la base de un caparazón vacío y, por lo tanto, no infeccioso de un virus fago, Investigadores de Berlín han desarrollado una cápside de fagos modificada químicamente que sofoca los virus de la influenza.
Los sitios de unión que encajan perfectamente hacen que los virus de la influenza sean envueltos por las cápsides de fagos de tal manera que sea prácticamente imposible que infecten las células pulmonares. Este fenómeno se ha probado en ensayos preclínicos que utilizan tejido pulmonar humano. Investigadores de Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP), Freie Universität Berlín, Technische Universität Berlin (TU), Humboldt-Universität (HU), el Instituto Robert Koch (RKI) y la Charité-Universitätsmedizin de Berlín informan que los resultados también se están utilizando para la investigación inmediata del coronavirus. Los hallazgos ahora se han publicado en Nanotecnología de la naturaleza .
Los virus de la influenza siguen siendo muy peligrosos. La Organización Mundial de la Salud (OMS) estima que la gripe es responsable de hasta 650, 000 muertes por año en todo el mundo. Los medicamentos antivirales actuales son solo parcialmente efectivos porque atacan al virus de la influenza después de que las células pulmonares se han infectado. Sería deseable, y mucho más eficaz, prevenir la infección en primer lugar.
Esto es exactamente lo que promete el nuevo enfoque de Berlín. La cápside del fago, desarrollado por un equipo multidisciplinario de investigadores, envuelve los virus de la gripe tan perfectamente que ya no pueden infectar las células. "Los ensayos preclínicos muestran que podemos hacer inofensivos tanto los virus de la influenza estacional como los virus de la influenza aviar con nuestra capa de fagos modificada químicamente, "explicó el profesor Dr. Christian Hackenberger, Jefe del Departamento de Biología Química de Leibniz-Forschungsinstitut für Molekulare Pharmakologie (FMP) y Profesor Leibniz Humboldt de Biología Química en HU Berlin. "Es un gran éxito que ofrece perspectivas completamente nuevas para el desarrollo de fármacos antivirales innovadores".
Múltiples enlaces encajan como velcro
El nuevo inhibidor utiliza receptores trivalentes en la superficie del virus de la influenza, conocida como proteína hemaglutinina, que se adhieren a las moléculas de azúcar (ácidos siálicos) en las superficies celulares del tejido pulmonar. En caso de infección, los virus se enganchan a su víctima, en este caso, células pulmonares, como un cierre de velcro. El principio fundamental es que estas interacciones ocurren debido a múltiples enlaces, en lugar de enlaces simples.
Fue la estructura de la superficie de los virus de la gripe lo que inspiró a los investigadores a hacer la siguiente pregunta inicial hace más de seis años:¿No sería posible desarrollar un inhibidor que se una a los receptores trivalentes con un ajuste perfecto? simulando la superficie de las células del tejido pulmonar?
Descubrieron que esto es posible con la ayuda de un habitante intestinal inofensivo:el fago Q-beta tiene las propiedades de superficie ideales y es excelente para equiparlo con ligandos; en este caso, moléculas de azúcar, como "cebo". Una cáscara de fago vacía hace el trabajo a la perfección. "Nuestra molécula de andamio multivalente no es infecciosa, y comprende 180 proteínas idénticas que están espaciadas exactamente como los receptores trivalentes de la hemaglutinina en la superficie del virus, "explicó el Dr. Daniel Lauster, un ex Ph.D. estudiante en el Grupo de Biofísica Molecular (HU) y ahora un postdoctorado en Freie Universität Berlin. "Por lo tanto, tiene las condiciones iniciales ideales para engañar al virus de la influenza, o ser más preciso, para unirlo con un ajuste espacial perfecto. En otras palabras, ¡Usamos un virus de fagos para desactivar el virus de la influenza! "
Para permitir que el andamio Q-beta cumpla la función deseada, primero debe modificarse químicamente. Producido a partir de la bacteria E. coli en TU Berlin, El grupo de investigación del profesor Hackenberger en FMP y HU Berlin utiliza química sintética para unir moléculas de azúcar a las posiciones definidas de la capa del virus.
El virus es engañado y envuelto
Varios estudios que utilizan modelos animales y cultivos celulares han demostrado que la estructura esférica adecuadamente modificada posee una fuerza de unión considerable y un potencial inhibidor. El estudio también permitió al Instituto Robert Koch examinar el potencial antiviral de las cápsides de fagos contra muchas cepas actuales del virus de la influenza. e incluso contra los virus de la gripe aviar. Su potencial terapéutico incluso ha sido probado en tejido pulmonar humano, como compañeros investigadores del Departamento Médico, División de Infectiología y Neumología, de Charité pudieron mostrar:Cuando el tejido infectado con los virus de la gripe se trató con la cápside del fago, los virus de la influenza prácticamente ya no podían reproducirse.
Los resultados están respaldados por pruebas estructurales de científicos de FU del Centro de Investigación de Microscopía Electrónica (FZEM):la microscopía crioelectrónica de alta resolución y la microscopía crioelectrónica muestran directa y espacialmente que el inhibidor encapsula completamente el virus. Además, Se utilizaron modelos matemático-físicos para simular la interacción entre los virus de la influenza y la cápside del fago en la computadora. "Nuestros cálculos asistidos por computadora muestran que el inhibidor diseñado racionalmente sí se adhiere a la hemaglutinina, y envuelve completamente el virus de la influenza, "confirmó la Dra. Susanne Liese de la AG Netz de Freie Universität Berlin. Por lo tanto, también fue posible describir y explicar matemáticamente la alta resistencia de la unión".
El potencial terapéutico requiere más investigación
Estos hallazgos ahora deben ser seguidos por más estudios preclínicos. Aún no se sabe, por ejemplo, si la cápside del fago provoca una respuesta inmune en mamíferos. Idealmente, esta respuesta podría incluso potenciar el efecto del inhibidor. Sin embargo, también podría darse el caso de que una respuesta inmune reduzca la eficacia de las cápsides de fagos en el caso de exposición a dosis repetidas, o que los virus de la gripe desarrollen resistencias. Y, por supuesto, aún no se ha demostrado que el inhibidor también sea eficaz en humanos.
Sin embargo, La alianza de investigadores de Berlín está segura de que el enfoque tiene un gran potencial. "Nuestro desarrollado racionalmente, tridimensional, El inhibidor multivalente apunta a una nueva dirección en el desarrollo de quelantes del virus de la influenza estructuralmente adaptables. Este es el primer logro de este tipo en la investigación de multivalencia, "enfatizó el profesor Hackenberger. El químico cree que este enfoque, que es biodegradable, no tóxico y no inmunogénico en estudios de cultivo celular, en principio, también se puede aplicar a otros virus, y posiblemente también a las bacterias. Es evidente que los autores consideran la aplicación de su enfoque al coronavirus actual como uno de sus nuevos desafíos. La idea es desarrollar un fármaco que evite que los coronavirus se unan a las células huésped ubicadas en la garganta y las vías respiratorias posteriores. previniendo así la infección.