
Reconfiguración de patrones de las paredes fluidas. Ver película completa en, Crédito:Science Advances, doi:10.1126 / sciadv.aav8002
Las placas de cultivo celular que se utilizan a diario en biología se pueden transformar eficazmente en dispositivos de microfluidos. abriendo caminos para que los biólogos miniaturicen los flujos de trabajo basados en células. En un informe reciente, Doctor. el investigador Cristian Soitu y colaboradores de los departamentos de Ingeniería y Patología de la Universidad de Oxford, Oxford, REINO UNIDO., describió un método simple para crear arreglos de microfluidos alrededor de las células. En el estudio, las células ya estaban creciendo en superficies estándar de placas de Petri, cuando los científicos utilizaron la interfaz entre los medios fluidos inmiscibles en el contenedor como material de construcción.
Reordenaron las placas de cultivo celular convencionales en sofisticados dispositivos de microfluidos bajo demanda al remodelar las estructuras de los fluidos alrededor de las células vivas. Soitu describe la nueva técnica de modelado de fluidos construida por su equipo de investigación como "estructuras fluidas para aquellas células que temen comprometerse al elegir una casa; se pueden quitar fácilmente y se pueden construir otras nuevas (con una geometría diferente) en su lugar". La investigación ahora se publica en Avances de la ciencia
Los investigadores demostraron el método utilizando flujos de trabajo que implican la clonación de células; clonación selectiva de un clon específico de entre otros en un plato; tratamientos farmacológicos; y cicatrización de heridas. El trabajo de investigación demostró un enfoque versátil, junto con características biológicamente amigables para promover la tecnología de microfluidos entre los biólogos. Los enfoques basados en microfluidos han ganado popularidad en muchos flujos de trabajo, aunque su aceptación en la biología convencional sigue siendo lenta debido a una variedad de razones que contribuyen, incluso:
En el pasado, Los científicos crearon construcciones tridimensionales con paredes fluidas a nanoescala, aunque queda por evaluar su biocompatibilidad. En el presente trabajo, por lo tanto, Soitu y col. desarrolló un método para hacer matrices de cámaras de microfluidos aisladas en placas de Petri vírgenes para adaptarse a los principales flujos de trabajo en biología celular. Los posibles ejemplos incluyen la alimentación y transferencia de células, clonación criopreservación, fijación e inmunomarcaje, lisis celular y reacción en cadena de la polimerasa con transcripción inversa (RT-PCR) y edición del gen CRISPR-Cas9. En experimentos anteriores de tales flujos de trabajo, los científicos agregaron las células después de la fabricación de microfluidos.
En el presente trabajo, los investigadores crearon una variedad de arreglos de microfluidos en placas de Petri estándar que contienen células adherentes y las reconfiguraron en tiempo real. Aislaron y recuperaron clones de células para realizar pruebas de drogas de prueba de concepto y ensayos de curación de heridas e introdujeron la nueva técnica para crear y reconfigurar circuitos de microfluidos en placas de Petri mientras las células crecían y se dividían. con muchas aplicaciones potenciales en la biología convencional.
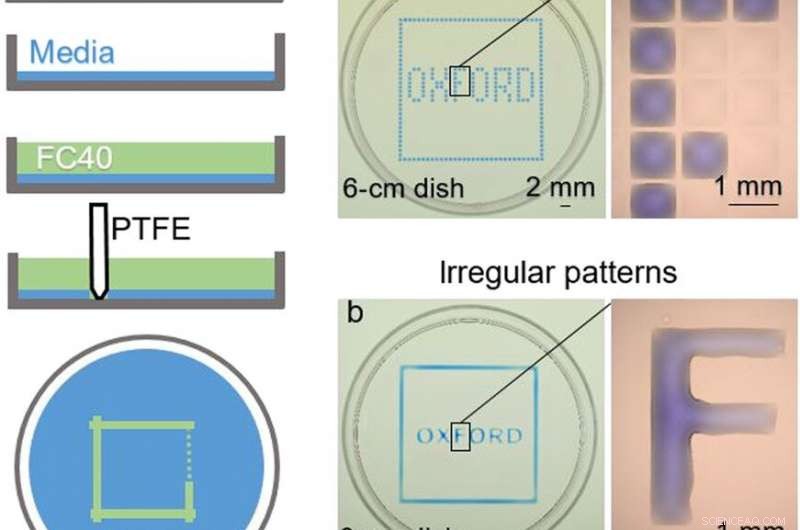
ARRIBA:Construcción de cámara. (A) Principio. Se agrega medio de Eagle modificado de Dulbecco (DMEM) + suero bovino fetal al 10% (FBS) a una placa de Petri virgen, y la mayor parte del medio se elimina para dejar una película delgada que cubra el fondo, que se superpone con FC40. El lápiz se mueve por la parte inferior para crear una disposición de microfluidos. Cuando esté completo, el volumen inicial de DMEM + FBS al 10% se dividirá en dos partes separadas por una pared líquida continua de FC40 fijada al sustrato. (B) Diferentes patrones. (a) La formación de líneas verticales y horizontales igualmente espaciadas crea una matriz (32 × 32; espaciado de 1 mm). Próximo, La impresora añade 60 nl de tinte azul a las cámaras seleccionadas; las cámaras periféricas reciben tinte azul para dar el cuadrado azul, y los internos dan la palabra "OXFORD". El aumento (derecha) muestra cámaras individuales sin y con tinte. (b) Se crea un patrón similar formando dos cuadrados (uno ligeramente más grande que el otro) con el lápiz y luego agregando tinte manualmente en el espacio intermedio; cada letra se hace formando sus lados y nuevamente llenando manualmente el interior. El aumento muestra que la letra "F" es un cuerpo continuo de líquido. Crédito de la foto:Cristian Soitu, Universidad de Oxford. INFERIOR:Reconfiguración de arreglos de microfluidos. Las imágenes muestran fotogramas de la película. (1) Se imprime un patrón inicial:un círculo (radio, 1,5 mm) dentro de un triángulo (lado, 7 mm) dentro de un cuadrado (lateral, 9 mm). (2 a 4) Se añaden tintes diferentes a cada compartimento (1,5 μl de tinte rojo, 1,5 μl de tinte amarillo, y 5 µl de colorante azul); los tintes están confinados dentro de las paredes FC40. (5) Se agrega más tinte amarillo al círculo. (6) Después de agregar 3 μl de tinte amarillo, la línea de fijación circular se rompe y el contenido se derrama en el triángulo. (7) Después de agregar 24 μl, la línea triangular de fijación se rompe y el contenido se derrama en el cuadrado. (8) Se retiran sesenta microlitros del cuadrado. (9) Se imprime un nuevo patrón:un triángulo (lado, 4,5 mm) en un círculo (radio, 3,3 mm), en el cuadrado inicial. (10 a 12) Los tintes de colores se agregan a los tres compartimentos diferentes como antes. Crédito de la foto:Cristian Soitu, Universidad de Oxford. Crédito:Science Advances, doi:10.1126 / sciadv.aav8002
La nueva técnica y los experimentos de prueba de concepto
En los experimentos que siguieron, Los investigadores primero cubrieron el fondo de una placa de Petri con medio de cultivo de tejidos y eliminaron la mayor parte del medio para formar una película delgada que cubría el sustrato de poliestireno. Cubrieron la película delgada con un fluorocarbono inmiscible (FC40) para evitar la evaporación y como barrera contra contaminantes externos para mantener la esterilidad del medio. Luego, usando una punta de teflón, los investigadores se pusieron en contacto con el fondo del plato, desplazar la fase acuosa para formar arreglos de microfluidos en la forma de interés, en este caso, un cuadrado. Usando la técnica, los investigadores llevaron las ventajas de la plataforma microfluídica abierta al material de cultivo celular estándar.
Soitu y col. dio forma a la fase acuosa para crear una rejilla con bajos volúmenes de líquido como lo demostró previamente el mismo equipo, y los vio con tintes selectivos en cámaras selectivas. Por ejemplo, las cámaras periféricas recibieron un tinte azul (formando un cuadrado azul) y las del interior formaron la palabra "OXFORD".

Creación de cámaras para el aislamiento de clones celulares. Ver película completa en, Crédito:Science Advances, doi:10.1126 / sciadv.aav8002
Los investigadores "imprimieron" un círculo dentro de un triángulo dentro de un cuadrado y utilizaron microlitros de tres tintes para ver las tres formas por separado; donde FC40 impidió que los tintes se mezclaran. Los resultados mostraron capacidad para construir y destruir paredes FC40 para confinar eficazmente los líquidos en cualquier forma bidimensional deseada.
Después de los resultados preliminares de la prueba de concepto, Soitu y col. generaron matrices de cámaras para recapitular la clonación de células tumorales mamarias de ratón (NM18), para los que inicialmente crearon cuadrículas, seguido de la adición de células a partir de entonces. Los investigadores primero permitieron que las células crecieran libremente rodeadas por la pared FC40 permeable a ambos O 2 y compañía 2 , y luego haciendo crecer células individuales en clones antes de rodearlas con paredes fluidas de diferentes formas.
Demostraron que las paredes fluidas con diferentes huellas 2-D se podían construir fácilmente alrededor de las células vivas. siempre que las colonias permanezcan aisladas unas de otras durante el tratamiento o la recuperación posteriores. Estudios previos que hicieron crecer células dentro de confinados, Las superficies prefabricadas requerían un tratamiento superficial antes de la adhesión celular, lo que contribuye a la notable excepción en la presente técnica.
Aplicaciones en selección de clones y pruebas de drogas
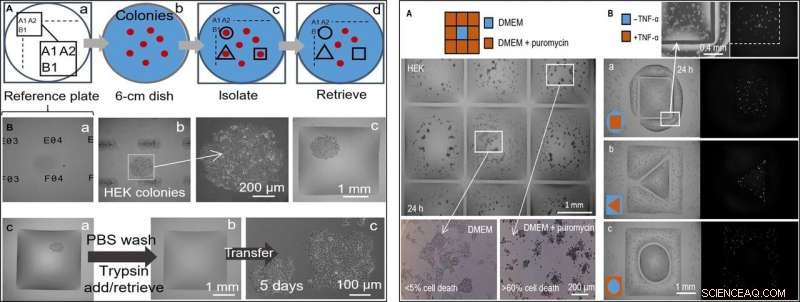
IZQUIERDA:Selección de clones selectiva semiautomatizada (células HEK). La impresora agrega / quita un microlitro hacia / desde cámaras en diferentes etapas. (A) Enfoque. (a) Las ubicaciones en una "placa de referencia" de vidrio están marcadas con identificadores únicos (es decir, A1, A2…, B1…). (b) Se coloca una placa de 6 cm con colonias (rojo) en la placa de referencia. (c) Después de registrar las ubicaciones de las colonias e ingresarlas en un guión, Las paredes fluidas se imprimen alrededor de clones seleccionados (líneas negras). (d) Los clones se recuperan de estas cámaras. (B) Aislar un clon. Las células HEK se sembraron en placas a baja densidad (~ 1 célula / cm2) y se cultivaron (8 días) en clones, el plato se colocó en una placa de referencia, y se construyeron muros alrededor de clones seleccionados. Se muestran tres vistas diferentes del eje z de un clon. (a) Placa de referencia con identificadores únicos enfocados. (b) Colonia enfocada (identificadores desenfocados) con aumento. (c) Colonia después de construir muros circundantes. (C) Recolección de clones. (a) Muro cuadrado construido alrededor de una colonia viviente. La impresora lava las células agregando / recuperando 1 μl de PBS; luego añade 1 µl de tripsina. (b) La placa se incuba (37 ° C; 5 min) para separar las células de la superficie, y la impresora recupera 1 μl que contiene la suspensión rica en células (y la transfiere a un tubo de microcentrífuga) para dejar la cámara ahora vacía. (c) Las células recuperadas se siembran manualmente en una placa de microvaloración de 12 pocillos y se cultivan de forma convencional durante 5 días; las células se adhieren y crecen. DERECHA:Dos tratamientos farmacológicos en paralelo con células no tratadas. Se construyeron paredes fluidas alrededor de las celdas HEK (300, 000 células; Plato de 6 cm) cultivado durante 24 horas. (A) Puromicina (cuadrícula de 3 × 3; cámaras de 2 mm × 2 mm). La impresora agrega 1 μl de medio a la cámara central y 1 μl de medio + puromicina a las periféricas (concentración final, 10 μg / ml), como se indica en la caricatura. La viabilidad celular se evalúa después de la incubación (37 ° C; 24 horas) usando un ensayo de exclusión con azul tripán. Las células en las cámaras externas están muertas (más del 60% en cada una), mientras que los del central permanecen vivos (menos del 5% de muerte celular). Este ensayo se ha replicado tres veces. (B) TNF-α. Se imprimen pares de cámaras con formas distintas, uno rodeando al otro. La impresora agrega 0,5 μl de medio ± TNF-α (concentración final, 10 ng / ml) a uno u otro volumen (como en los dibujos animados). Como las células codifican un gen indicador de GFP controlado por un promotor activado por TNF-α, emiten una fluorescencia verde al exponerse a la citocina. Las imágenes de fluorescencia muestran que solo las células en el volumen tratado tienen fluorescencia verde. Los pares de volumen tenían las siguientes dimensiones:(a) cuadrado (lado, 1,8 mm) en círculo (radio, 1,75 mm); (b) triángulo (lado, 1 mm) en cuadrado (lateral, 3,5 mm); (c) círculo (radio, 1 mm) en cuadrado (lateral, 3,5 mm). Crédito:Science Advances, doi:10.1126 / sciadv.aav8002
En el siguiente paso, los investigadores crearon una placa de referencia en la que colocaron una placa que contenía colonias de células vivas de interés para aislar clones de células de interés de otras imprimiendo paredes de fluido a su alrededor. En aislamiento, podrían recoger las colonias, recuperar las células y cultivarlas de forma convencional para que se multipliquen como se esperaba. Dado que las paredes de fluido podrían confinar efectivamente los líquidos, Soitu y col. probó su eficacia agregando puromicina, un inhibidor del traductor de moléculas pequeñas que mata las células de mamíferos.
En la configuración experimental de detección de drogas, Permitieron que la cámara central recibiera solo medio de crecimiento, mientras que la droga se entregó a las cámaras circundantes en una dosis letal alta, para mostrar la eficacia de la separación de FC40 cuando solo sobrevivieron las líneas celulares en la cámara central. En un segundo ejemplo, Soitu y col. explotó la propiedad de una línea celular de riñón embrionario humano genéticamente modificada para codificar un gen promotor fluorescente verde. Que se encendió en presencia del factor de necrosis tumoral-α para emitir una luz verde fluorescente. Las paredes de fluido formaron barreras efectivas para la exposición a las drogas, verificar el potencial de detección de drogas de la técnica.
Aplicaciones en la cicatrización de heridas
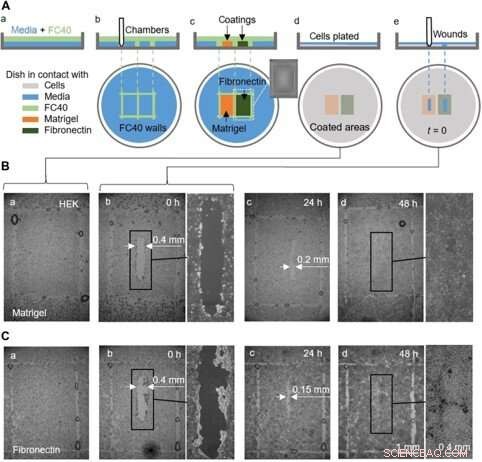
Un ensayo de curación de heridas de prueba de concepto utilizando una placa prerrevestida con Matrigel y fibronectina en diferentes regiones. (A) Caricatura que ilustra el flujo de trabajo. (a) Una fina capa de medio se superpone con FC40. (b) Se imprimen dos cámaras (de 3 mm × 4 mm cada una) una al lado de la otra. (c) Las superficies de las cámaras se recubren con Matrigel o fibronectina (2 µl; concentración final de 1 µg / cm2; 1 hora); el recuadro muestra una imagen de una cámara. Las paredes fluidas ahora están destruidas, y la placa se lava con 3 ml de medio para eliminar las capas sueltas. (d) celdas HEK (600, 000) se colocan en el plato. (e) Después de 24 horas, las células han formado una monocapa, y se crea una herida (0,4 mm × 2 mm) raspando la aguja sobre la superficie para eliminar las células en su camino. La cicatrización de la herida ahora se controla microscópicamente. (B y C) Imágenes de heridas en monocapas cultivadas en Matrigel o fibronectina. (ayb) Inmediatamente antes y después de la herida (algunas gotas de FC40 permanecen donde estaban las paredes originalmente). (c) Después de 24 horas, el crecimiento celular reduce el ancho de la herida a <0,2 mm y <0,15 mm con Matrigel y fibronectina, respectivamente. (d) A las 48 horas, las heridas se han curado por completo. Crédito:Science Advances, doi:10.1126 / sciadv.aav8002
También completaron ensayos de curación de heridas de prueba de principio utilizando un solo plato recubierto de dos formas diferentes, para controlar dos condiciones de cicatrización de heridas. Para esto, los investigadores utilizaron Matrigel, una proteína gelatinosa secretada por las células del sarcoma y fibronectina, una glicoproteína de la matriz extracelular que mejoró la cicatrización de las heridas. Agregaron células HEK que formaron una monocapa en las placas y crearon una "herida" al arrastrar la punta de teflón a través de la monocapa cuando las células migraron hacia las heridas a velocidades ligeramente diferentes. Aunque en este flujo de trabajo Soitu et al. recubierto previamente la superficie antes de plantar las células, también podrían modificar la técnica de recubrimiento para su adición después de que las células comenzaran a migrar hacia las heridas recién formadas para promover la cicatrización.
De este modo, Cristian Soitu y sus compañeros de trabajo desarrollaron una plataforma de microfluidos para miniaturizar los flujos de trabajo en biología celular. Ampliaron la técnica en el presente trabajo para formar arreglos de microfluidos alrededor de las células adherentes pre-plateadas seguidas de una variedad de ensayos de prueba de principio sobre la clonación celular. detección de drogas y cicatrización de heridas. La plataforma tiene muchas ventajas y puede reemplazar el modo convencional de dispositivos microfluídicos prediseñados como una alternativa flexible y personalizable. Los nuevos arreglos de microfluidos son rentables y contribuyen a la ciencia frugal y se pueden reconfigurar en tiempo real durante un experimento para una mayor versatilidad. Los investigadores notan limitaciones de la técnica, incluidas las disposiciones restringidas en 2-D y la fragilidad de las paredes fluidas en comparación con las paredes sólidas. Soitu y col. Esperamos optimizar y combinar estas características y ventajas para proporcionar una nueva plataforma para que los biólogos convencionales exploren el poder de los microfluidos.
© 2019 Science X Network