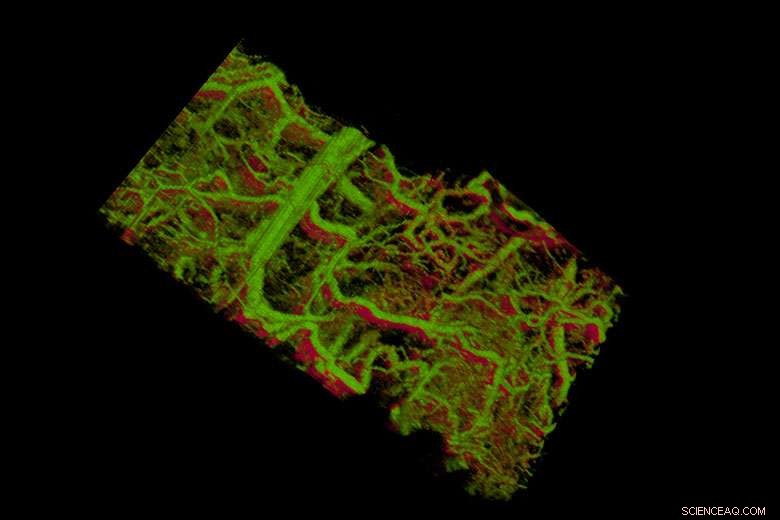
Las nanovarillas de oro dentro de los vasos sanguíneos de la oreja de un ratón aparecen de color verde. La parte inferior derecha muestra los vasos dentro de un tumor que se encuentra debajo de la piel. Crédito:laboratorio de la Zerda
Los científicos tienen muchas herramientas a su disposición para observar el tejido preservado bajo un microscopio con increíble detalle. o mirar dentro del cuerpo vivo con una resolución más baja. Lo que no han tenido es una forma de hacer ambas cosas:crear una imagen tridimensional en tiempo real de células individuales o incluso moléculas en un animal vivo.
Ahora, Los científicos de Stanford han proporcionado el primer vistazo bajo la piel de un animal vivo, mostrando intrincados detalles en tiempo real en tres dimensiones de los vasos linfáticos y sanguíneos.
La técnica, llamado MOZART (para la obtención de imágenes moleculares y la caracterización de tejidos de forma no invasiva en resolución celular), algún día podría permitir a los científicos detectar tumores en la piel, colon o esófago, o incluso para ver los vasos sanguíneos anormales que aparecen en las primeras etapas de la degeneración macular, una de las principales causas de ceguera.
"Hemos intentado examinar el cuerpo vivo y ver información a nivel de una sola célula, "dijo Adam de la Zerda, profesor asistente de biología estructural en Stanford y autor principal del artículo. "Hasta ahora no ha habido forma de hacer eso".
De la Zerda, quien también es miembro de Stanford Bio-X, dijo que la técnica podría permitir a los médicos monitorear cómo un tumor que de otro modo sería invisible debajo de la piel está respondiendo al tratamiento, o para comprender cómo las células individuales se liberan de un tumor y viajan a sitios distantes.
Vamos por oro
Existe una técnica para mirar en un tejido vivo varios milímetros debajo de la piel, revelando un paisaje de celdas, tejidos y vasos. Pero esa técnica, llamada tomografía de coherencia óptica, u OCT, no es lo suficientemente sensible o específico para ver las células individuales o las moléculas que las células están produciendo, que es lo que le interesa a de la Zerda.
Un problema importante ha sido encontrar una forma de diferenciar entre células o tejidos; por ejemplo, seleccionar las células cancerosas que comienzan a multiplicarse dentro de un tejido sano en general. En otras formas de microscopía, Los científicos han creado etiquetas que se adhieren a moléculas o estructuras de interés para iluminar esas estructuras y proporcionar una vista detallada de dónde se encuentran en la célula o el cuerpo.
No existían tales balizas para OCT, aunque de la Zerda sabía que unas partículas diminutas llamadas nanobarras de oro tenían algunas de las propiedades que estaba buscando. El problema era que las nanovarillas disponibles comercialmente no producían suficiente señal para ser detectadas en un tejido.
Lo que necesitaba el equipo eran nanobarras, pero grandes. Los nanorods son análogos a los tubos de órgano, dijo el estudiante de posgrado Elliott SoRelle, porque los tubos más largos vibran a frecuencias más bajas, creando una profunda, Sonido bajo. Igualmente, nanobarras más largas vibran a frecuencias más bajas, o longitudes de onda, de luz. Esas vibraciones esparcen la luz que detecta el microscopio.
Si todos los demás tejidos vibran en un ruido blanco de frecuencias más altas, nanobarras más largas se destacarían como notas bajas de órgano en medio de una habitación de balbuceo.
El desafío de SoRelle era fabricar nanobarras más largas que no fueran tóxicas, estable y muy brillante, que resultó ser mucho pedir. "Mi experiencia fue la bioquímica, y esto resultó ser un problema de ciencia de materiales y química de superficies, "dijo SoRelle, quien fue el co-primer autor del artículo. Ahora puede fabricar nanobarras no tóxicas en varios tamaños que vibran a frecuencias únicas e identificables.
Eliminando ruido
El siguiente desafío fue filtrar la frecuencia de las nanovarillas del tejido circundante.
Para hacer eso, Orly Liba, estudiante de posgrado en ingeniería eléctrica y becaria de Bowes Bio-X, desarrolló algoritmos informáticos que podían separar las frecuencias de la luz dispersada por nanobarras de varias longitudes y diferenciarlas del tejido circundante.
Con las grandes nanovarillas de SoRelle y los algoritmos sensibles de Liba, de la Zerda y su equipo habían resuelto el problema inicial de detectar estructuras específicas en imágenes tridimensionales de tejidos vivos. El tridimensional resultante, Las imágenes de alta resolución eran tan grandes, del orden de gigapíxeles, que el equipo necesitaba desarrollar algoritmos adicionales para analizar y almacenar imágenes tan grandes.
El equipo probó su tecnología en el oído de un ratón vivo, donde pudieron observar cómo las nanovarillas eran llevadas al sistema linfático y transportadas a través de una red de válvulas. Pudieron distinguir entre dos nanobarras de diferentes tamaños que resonaban en diferentes longitudes de onda en vasos linfáticos separados, y podían distinguir entre esas dos nanovarillas en el sistema linfático y los vasos sanguíneos. En un estudio, podían observar las válvulas individuales dentro de los vasos linfáticos abrirse y cerrarse para controlar el flujo de líquido en una sola dirección.
"Nadie ha mostrado ese nivel de detalle antes, "dijo Liba, quien fue el co-primer autor del artículo.
Meta imposible
Esta imagen detallada fue el objetivo inicial de De la Zerda cuando comenzó su laboratorio en 2012, aunque con frecuencia se le dijo que sería imposible. "Estoy en un departamento pequeño, pero con una facultad muy consumada, ", dijo." Un miembro de la facultad me contó la historia de su propia vida de tomar grandes riesgos y eso me animó. Pensé que sería muy divertido ver si podemos hacer que funcione y ver a las células hablando entre sí en tiempo real ".
Su apuesta despegó principalmente con una subvención inicial de Stanford Bio-X, que apoya la investigación interdisciplinaria en etapa inicial. "Esa subvención nos permitió correr un gran riesgo en una dirección que no estaba completamente probada, "dijo de la Zerda.
Habiendo demostrado que las nanovarillas de oro se pueden ver en tejidos vivos, el siguiente paso es mostrar que esas nanovarillas pueden unirse a tipos específicos de células, como cáncer de piel o vasos anormales en la degeneración macular en etapa temprana. Luego, la técnica podría usarse para aprender más sobre cómo esas enfermedades progresan a nivel molecular y también evaluar tratamientos en pacientes individuales, algo que antes no había sido posible.