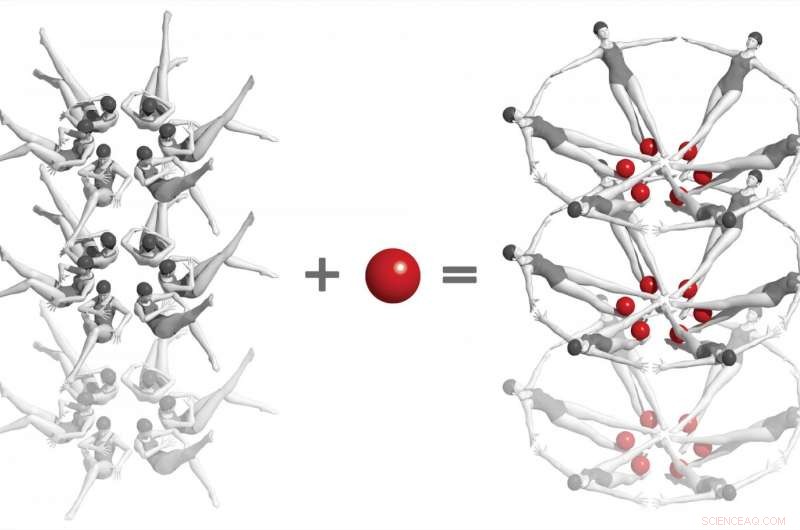
En un experimento histórico en SLAC National Accelerator Laboratory, Los científicos utilizaron un láser de rayos X para capturar las primeras instantáneas de una interacción química entre dos biomoléculas en tiempo real y a nivel atómico. Se trata de "riboswitches" de ARN bacteriano, que se muestran aquí como nadadores sincronizados, y una pequeña molécula llamada adenina (bolas rojas). Cuando los dos interactúan, los riboswitches cambian a una forma dramáticamente diferente, y esto, a su vez, cambia la forma de los cristales en los que están incrustados. Estudios como estos, que solo se puede hacer con láseres de rayos X de electrones libres, abrir un camino para comprender cómo funcionan el ARN y otras biomoléculas complejas, y, en última instancia, al desarrollo de tratamientos para enfermedades. Crédito:Joseph Meyer / Laboratorio Nacional Frederick para la Investigación del Cáncer
Los científicos han utilizado el poderoso láser de rayos X en el Laboratorio Nacional Acelerador SLAC del Departamento de Energía para hacer las primeras instantáneas de una interacción química entre dos biomoléculas, una que activa un "interruptor" de ARN que regula la producción de proteínas, las moléculas de caballo de batalla de la vida.
Los resultados, publicado hoy en Naturaleza , mostrar el potencial de cambio de juego de los láseres de rayos X de electrones libres, o XFEL, para estudiar ARN, que guía la producción de proteínas en la célula, sirve como material genético primario en retrovirus como el VIH y también juega un papel en la mayoría de las formas de cáncer.
Y debido a que este tipo particular de cambio de ARN, conocido como riboswitch, se encuentra solo en bacterias, una comprensión más profunda de su función puede ofrecer una forma de detener la producción de proteínas y matar los gérmenes dañinos sin causar efectos secundarios en los seres humanos que infectan.
"Experimentos anteriores en el láser de rayos X de SLAC han estudiado reacciones biológicas como la fotosíntesis que se desencadenan por la luz. Pero este es el primero en observar una que se desencadena por la interacción química de dos biomoléculas en tiempo real y a escala atómica, "dijo Yun-Xing Wang, un biólogo estructural en el Centro de Investigación del Cáncer del Instituto Nacional del Cáncer que dirigió el equipo de investigación internacional.
"Esto realmente demuestra la capacidad única que ofrecen los láseres de rayos X de electrones libres que ninguna tecnología actual, o cualquier otra tecnología en el horizonte, puede hacer. Es como si tuvieras una cámara con una velocidad de obturación muy rápida, para que pueda captar cada movimiento de las biomoléculas en acción ".
Los experimentos se llevaron a cabo en la fuente de luz coherente Linac (LCLS) de SLAC, una instalación para usuarios de la Oficina de Ciencias del DOE. Son los primeros en demostrar cómo los XFEL pueden tomar instantáneas y potencialmente hacer películas de ARN y otras biomoléculas a medida que interactúan químicamente, ofreciendo vislumbres del funcionamiento fundamental de la célula que no se pueden obtener de otra manera.
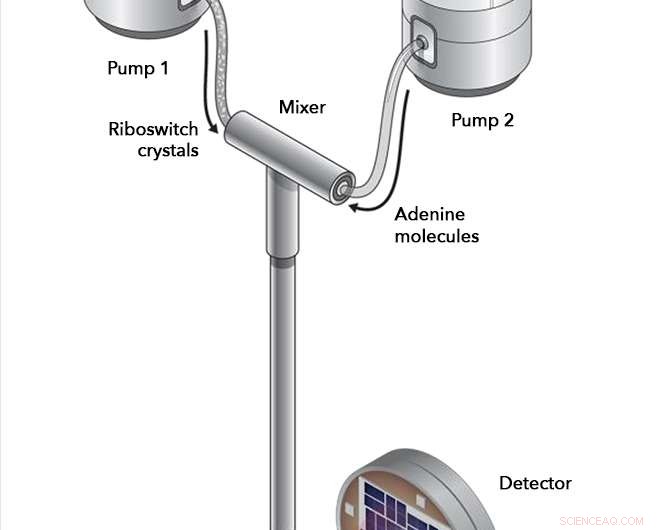
En experimentos en la fuente de luz coherente Linac de SLAC, Se bombearon cristales de riboswitch y moléculas de adenina a una cámara de mezcla, donde se les permitió interactuar durante intervalos cuidadosamente cronometrados antes de ser inyectados en la trayectoria del rayo láser de rayos X. Los rayos X rebotaron en las moléculas del riboswitch y entraron en un detector, registrando cualquier cambio en la estructura del riboswitch que tuvo lugar. Crédito:Joseph Meyer / Instituto Nacional del Cáncer
Ver el cambio de forma del ARN
El ARN es una parte clave del material genético en todas las células vivas. Viene en varios tipos que trabajan juntos para guiar la producción de proteínas por los ribosomas de la célula, según planos codificados en el ADN.
Pero tanto el ADN como el ARN también contienen extensas regiones que no codifican ninguna proteína, la llamada "materia oscura" genética. Los científicos pensaron durante muchos años que estas regiones no hacían nada. Ahora saben que juegan un papel importante a la hora de determinar dónde y cuándo se activan y desactivan los genes y, de lo contrario, ajustan su función. La gran mayoría de los cánceres se deben a mutaciones en estas regiones no codificantes, Wang dijo:por lo que comprender cómo funcionan estas regiones es importante para la investigación del cáncer, así como para la biología fundamental.
Sin embargo, Es difícil averiguar qué hacen las regiones no codificantes de ARN. Las moléculas de ARN son inestables y flexibles, por lo que es difícil incorporarlos a los grandes cristales que normalmente se necesitan para estudiar su estructura atómica en fuentes de luz de rayos X.
LCLS elimina esta barrera al permitir que los científicos obtengan información estructural de cristales nanométricos, que son mucho más fáciles de hacer. Sus potentes pulsos de láser de rayos X, mil millones de veces más brillante que cualquier otro disponible antes, son tan cortos que recopilan datos de cada cristal en unas millonésimas de mil millonésimas de segundo, antes de que se produzca el daño de los rayos X.
El equipo de Wang estudió un riboswitch de Vibrio vulnificus, una bacteria relacionada con la que causa el cólera. El riboswitch se encuentra en una cadena larga de ARN mensajero (ARNm), que copia las instrucciones del ADN para producir una proteína, de modo que el ribosoma pueda leerlas y ejecutarlas. El interruptor actúa como un termostato que regula la producción de proteínas.
En este caso, el ARNm guía la producción de una proteína que a su vez ayuda a producir una pequeña molécula llamada adenina. Cuando hay demasiada adenina en la célula bacteriana, Las moléculas de adenina entran en los bolsillos de los riboswitches y les dan una forma diferente, y esto cambia el ritmo de producción de proteínas y adenina.
Primeras imágenes fijas de una película elegante
Para los experimentos LCLS, los investigadores hicieron nanocristales que incorporaron millones de copias del riboswitch y los mezclaron con una solución que contenía moléculas de adenina. Cada cristal era tan pequeño que la adenina podía penetrar rápida y uniformemente en cada rincón, entrar en los bolsillos de los riboswitch y voltearlos casi instantáneamente, como si fueran millones de nadadores sincronizados ejecutando un solo movimiento impecable.
Los científicos tomaron instantáneas de esta interacción golpeando los cristales con pulsos de láser de rayos X a intervalos cuidadosamente cronometrados después de que comenzara la mezcla. Esto les dio el primer vistazo de una etapa intermedia fugaz en el proceso, que ocurrió en 10 segundos. Por separado, obtuvieron las primeras imágenes del riboswitch en su inicial, estado de bolsillo vacío, y descubrió que existía en dos configuraciones ligeramente diferentes, solo uno de los cuales participa en el cambio.
Los investigadores se sorprendieron al descubrir que el cambio repentino en la forma de los riboswitches fue tan dramático que cambió la forma de todo el cristal. también. Normalmente, un cambio importante como este rompería el cristal y estropearía el experimento. Pero debido a que estos cristales eran tan pequeños que se mantenían juntos, por lo que el láser de rayos X aún podría obtener información estructural de ellos.
"Para mí sigue siendo un misterio cómo se las arregló el cristal para hacer eso, "dijo Soichi Wakatsuki, profesor en SLAC y en la Escuela de Medicina de Stanford y jefe de la División de Biociencias del laboratorio, que no formaba parte del equipo de investigación. "En realidad, esto abre muchas posibilidades nuevas y nos brinda una nueva forma de ver cómo el ARN y las proteínas interactúan con moléculas pequeñas". así que esto es muy emocionante ".