Portada en línea:un mesoscopio computacional en miniatura (CM2). Crédito de la imagen:Xue et al., Avances científicos, doi:10.1126 / sciadv.abb7508
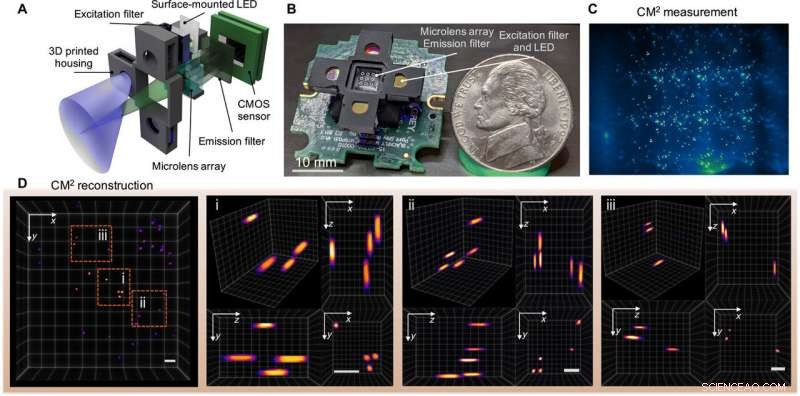
La fotografía de portada de la función en línea en Avances de la ciencia esta semana muestra imágenes de fluorescencia con un mesoscopio en miniatura computacional (CM 2 ). La técnica de imagen por fluorescencia es una herramienta fundamental para biólogos y neurocientíficos; sin embargo, Los microscopios convencionales y los microscopios miniaturizados (miniscopios) están limitados por un producto de ancho de banda de espacio limitado, una medida de la capacidad de información de un sistema óptico, poca profundidad de campo e incapacidad para resolver emisores distribuidos tridimensionales (3-D). Para superar los límites existentes, Yujia Xue y un equipo de investigadores en ingeniería eléctrica e informática, biología, neurofotónica e ingeniería biomédica en la Universidad de Boston, NOSOTROS., desarrolló un mesoscopio ligero y compacto conocido como mesoscopio computacional en miniatura (CM 2 ).
La nueva plataforma integró una microlente para imágenes y una matriz de LED para excitación dentro de la misma configuración. El dispositivo realizó imágenes tridimensionales de un solo disparo y facilitó una ganancia de campo de visión de 10 veces y una mejora de profundidad de campo de 100 veces. en comparación con los miniscopios existentes. Xue y col. probó el dispositivo con perlas y fibras fluorescentes junto con experimentos fantasmas para medir los efectos de la dispersión masiva y la fluorescencia de fondo. El equipo analiza la practicidad de este mesoscopio para amplias aplicaciones en biomedicina y registro neuronal 3-D.
Avanzando en la microscopía de fluorescencia
La microscopía de fluorescencia es una técnica clave en biología fundamental y neurociencia de sistemas. Los desarrollos tecnológicos recientes están destinados a superar las barreras de escala para investigar neuronas individuales de solo unas pocas micras de tamaño. Por ejemplo, macroscopios, los microscopios mesolens y los microscopios de dos fotones han comenzado a superar esta escala; sin embargo, el desarrollo de tales sistemas de imágenes está limitado por aberraciones geométricas dependientes de la escala de los elementos ópticos. El campo de visión alcanzable (FOV) también está limitado por la poca profundidad de campo del sistema en muchas aplicaciones de bioimagen. Los investigadores también se centran en miniaturizar la tecnología para permitir la obtención de imágenes in vivo en animales que se comportan libremente. Por ejemplo, microscopios miniaturizados conocidos como 'miniscopios' han obtenido un acceso sin precedentes a las señales neuronales, aunque los sistemas permanecen restringidos por su óptica, al igual que sus homólogos de microscopía de fluorescencia. Xue y col. por lo tanto introdujo y demostró un microscopio computacional en miniatura (CM 2 ) con gran escala, Mediciones de fluorescencia 3-D en un compacto, plataforma ligera.
Fluorescencia 3D de un solo disparo CM2. (A) El CM2 combina una óptica MLA y una matriz de excitación de diodos emisores de luz (LED) en una plataforma compacta y liviana. (B) Imagen del prototipo CM2 (se omiten los cables eléctricos y el controlador del sensor). Crédito de la foto:Yujia Xue, Universidad de Boston. (C) Medición de CM2 en partículas fluorescentes de 100 μm suspendidas en resina transparente. (D) Vista proyectada del volumen reconstruido CM2 (7,0 mm por 7,3 mm por 2,5 mm) y tres regiones de zoom con vistas ortogonales. Barras de escala, 500 μm. CMOS, semiconductor complementario de óxido de metal. Crédito:Science Advances, doi:10.1126 / sciadv.abb7508 
El equipo utilizó ópticas simples en la configuración para lograr la mejora del producto de ancho de banda espacial (SBP) y las capacidades de imágenes en 3-D sin la necesidad de un escaneo mecánico. La técnica pasó por alto los límites físicos de la óptica integrada al diseñar conjuntamente el hardware y el algoritmo. El CM 2 El método de obtención de imágenes combinó varias características diferentes de la obtención de imágenes microscópicas, como la imagen integral, microscopía de campo de luz e imágenes de apertura codificada. En su mecanismo de acción, el microscopio recogió una única medición 2-D utilizando una matriz de microlentes (MLA) para la posterior reconstrucción computacional de la distribución de fluorescencia 3-D.
El CM 2 utilizó la matriz de microlentes como único elemento de imagen y permitió que la configuración superara los límites del campo de visión (FOV) impuestos por la lente del objetivo de los microscopios convencionales. El CM 2 El algoritmo resolvió el problema de deconvolución de 2-D-a-3-D para proporcionar reconstrucciones con resolución en profundidad. Xue y col. explicó el principio del CM 2 capacidad de generación de imágenes tridimensionales de un solo disparo mediante una analogía con la multiplexación por división de frecuencia (FDM). Luego, el equipo cuantificó la resolución alcanzable del CM 2 calculando la función de transferencia de modulación 3-D (MTF) del sistema y analizando la resolución lateral.
Caracterización del principio de imagen del CM2, variación de cambio, y resolución. (A) El CM2 produce PSF de matriz que varían axialmente para lograr un corte óptico. El cizallamiento axial en los focos laterales está bien caracterizado por el modelo geométrico presentado en el estudio. El PCC de las PSF escaneadas axialmente cuantifica la resolución axial esperada. EM, emisión. (B) El MTF 3D (mostrado en escala logarítmica) muestra que el CM2 captura información de frecuencia axial extendida y agranda el SBP del sistema. El soporte del MTF experimental coincide con la teoría (en una curva de puntos y trazos). El ángulo de cada "banda" inclinada en la MTF se establece mediante la ubicación angular de la microlente correspondiente αMLA (en línea discontinua). (C) La variación del desplazamiento lateral se caracteriza por el PCC de las PSF escaneadas lateralmente. El PSF en el campo de visión central (marcado por líneas de límite naranjas) contiene focos de 3 × 3; el PSF en el campo de visión exterior (marcado por líneas de límite azules) contiene focos de 2 × 3 o 3 × 2; el PSF en el campo de visión de la esquina (marcado por líneas de límite amarillas) contiene focos de 2 × 2. (D) La resolución en diferentes regiones del campo de visión se caracteriza por la reconstrucción de un objeto estenopeico de 5 μm utilizando el modelo invariante de desplazamiento del CM2. El ancho total lateral a la mitad del máximo (FWHM) está constantemente por debajo de 7 μm. El FWHM axial es ~ 139 μm en el campo de visión central y se degrada a ~ 172 y ~ 189 μm en los campos de visión exterior y de esquina, respectivamente. (E) Geometría para obtener imágenes de un objetivo fluorescente inclinado. (F) Medición de CM2 sin procesar. (G) MIP del volumen reconstruido (8,1 mm por 5,5 mm por 1,8 mm). Las características de 7 μm (grupo 6, elemento 2) se puede resolver como se muestra en la proyección xy de acercamiento. La capacidad de corte axial se caracteriza por la proyección xz, validando la resolución axial dependiente del tamaño de la función. Crédito:Science Advances, doi:10.1126 / sciadv.abb7508 
Xue y col. aproximó la formación de la imagen del CM 2 configuración mediante el uso de un modelo invariante de desplazamiento por cortes. Caracterizaron la resolución y la variación del desplazamiento lateral de la configuración antes de la obtención de imágenes experimentales y obtuvieron imágenes de un objetivo de resolución fluorescente para validar la resolución lateral del CM. 2 . Validaron las observaciones utilizando medidas simuladas por Zemax para encontrar una buena concordancia entre las simulaciones y los experimentos. La nueva plataforma permitió a los científicos localizar emisores fluorescentes distribuidos en un gran volumen. Probaron el rendimiento de CM 2 en muestras con un tamaño de característica similar a una sola neurona. Durante estos experimentos, el CM 2 El algoritmo toleraba las degradaciones de la señal, como la reducción de la relación señal-ruido para permitir una alta calidad, reconstrucción de campo de visión completo. El equipo comparó el CM 2 reconstrucción y una pila axial adquirida por una lente de objetivo para demostrar la precisión de la localización de un solo disparo de partículas individuales.
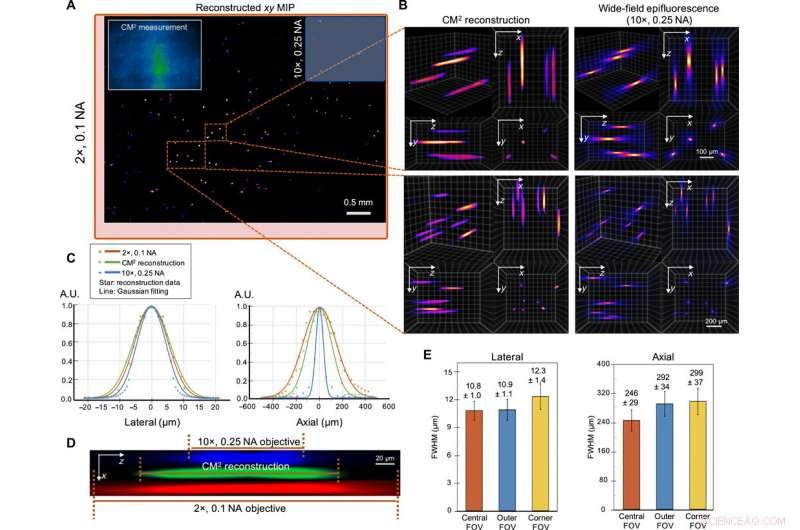
Imágenes 3D de un solo disparo de partículas fluorescentes de 10 μm en un volumen claro. (A) xy MIP del volumen reconstruido que abarca 5,7 mm por 6,0 mm por 1,0 mm. Recuadro superior izquierdo:medición CM2 sin procesar. El campo de visión del CM2 es comparable a un objetivo de 2 × (cuadro delimitador rojo) y es ~ 25 × más ancho que el lente objetivo de 10 × (cuadro delimitador azul). (B) Zoom de la reconstrucción CM2 3D comparada por la pila axial tomada por un 10 ×, Lente de objetivo de 0,25 NA. (C) Secciones transversales laterales y axiales de la partícula recuperada de 10 μm. Comparando con las mediciones de la microscopía de fluorescencia de campo amplio estándar, el CM2 recupera fielmente el perfil lateral de la partícula y consigue un corte en profundidad de un solo disparo. A.U., unidades arbitrarias. (D) xz vista en sección transversal de una partícula fluorescente reconstruida, en comparación con la pila axial adquirida de las lentes de objetivo 2 × y 10 ×. (E) Para caracterizar las variaciones espaciales de la reconstrucción, las estadísticas de los FWHM laterales y axiales de las partículas reconstruidas se trazan para el centro, exterior, y esquina FOV. El ancho lateral cambia solo ligeramente (~ 0,9%) en el campo de visión exterior, pero aumenta en el campo de visión de la esquina (~ 13,9%). El alargamiento axial se degrada de ~ 246 μm en el campo de visión central a ~ 292 y ~ 299 μm en las regiones de campo de visión exterior y de esquina, respectivamente. Crédito:Science Advances, doi:10.1126 / sciadv.abb7508
Experimentos con fibras fluorescentes en una superficie curva y en fantasmas de dispersión controlada.
A continuación, los científicos probaron la capacidad de obtener imágenes de muestras fluorescentes volumétricas complejas en fibras fluorescentes esparcidas sobre una superficie curva impresa en 3-D. imitando el perfil de la superficie de la corteza de un ratón, que abarca un amplio campo de visión y una profundidad extendida. El algoritmo recuperó con precisión las estructuras enfocadas y resolvió el objeto 3-D, mientras resuelve la mayoría de las fibras individuales. Además, el equipo llevó a cabo experimentos en ocho fantasmas de imágenes para probar el rendimiento de CM 2 bajo dispersión masiva y fuerte fluorescencia de fondo. Durante los experimentos, sembraron todos los fantasmas con la misma concentración de partículas fluorescentes diana y atribuyeron las diferencias en la reconstrucción a la dispersión masiva y la fluorescencia de fondo. Luego, el equipo incluyó partículas fluorescentes de fondo de 1,1 µm para imitar las fuentes fluorescentes irresolubles que se ven comúnmente en muestras biológicas; como los neutropilos en el cerebro. Cuantificaron el nivel de dispersión para cada fantasma, realizó la reconstrucción 3-D para cada fantasma de dispersión y realizó todas las deconvoluciones utilizando la misma configuración computacional. El rango de profundidad de reconstrucción estimado varió con las variaciones de superficie presentes en cada maniquí.

Reconstrucción de fibras fluorescentes. El archivo de película visualiza la reconstrucción volumétrica de fibras fluorescentes en una superficie curva. Para comparacion, el mapa de profundidad estimado a partir de la pila focal de un microscopio de epi-fluorescencia de campo amplio con un 2 ×, Se muestra una lente de objetivo de 0.1 NA. Crédito:Science Advances, doi:10.1126 / sciadv.abb7508
De este modo, Yujia Xue y sus colegas desarrollaron un nuevo sistema de imágenes de fluorescencia miniaturizado para permitir imágenes tridimensionales mesoscópicas de un solo disparo. El mesoscopio computacional en miniatura (CM 2 ) método integrado de imágenes de fluorescencia y los módulos de excitación en la misma plataforma compacta. El equipo presentó las simulaciones y experimentos para establecer el mecanismo de acción y la capacidad de imagen 3D del CM. 2 . Simularon imágenes de redes vasculares de todo el cerebro y los resultados primarios fueron prometedores. El CM 2 el prototipo aún no es comparable a las aplicaciones in vivo montadas en la cabeza (en modelos animales) en los laboratorios de neurociencia, aunque el equipo prevé optimizar el dispositivo para obtener imágenes in vivo corticales completas en ratones que se mueven libremente. El dispositivo de imágenes se puede mejorar aún más con más desarrollos en hardware y algoritmos para abrir nuevas y emocionantes oportunidades dentro de la grabación neuronal in vivo y las aplicaciones biomédicas.
© 2020 Science X Network