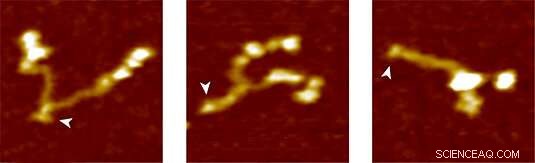
Proteína del factor Von Willebrand:completamente abierta (izquierda), parcialmente cerrado y completamente cerrado (derecha). Crédito:Grupo Lipfert
Los físicos de LMU han desarrollado un método altamente sensible para medir la estabilidad mecánica de las conformaciones de proteínas, y lo usó para monitorear los primeros pasos en la formación de coágulos de sangre.
Como mediadores centrales de la función celular en organismos biológicos, las proteínas participan en la ejecución de prácticamente todos los procesos celulares. Proporcionan el andamiaje interno que da forma a las células, y permitir que las células alteren dinámicamente su morfología. Transportan sustratos de un lado a otro a través de las membranas, y catalizan la mayoría de las reacciones químicas que tienen lugar en las células. En el curso de estas tareas, muchas proteínas están sujetas a fuerzas externas. En efecto, algunas proteínas "mecanosensibles" miden efectivamente la fuerza de las fuerzas que actúan sobre ellas y se activan cuando la fuerza impuesta excede un valor umbral dado. Factor de von Willebrand (VWF), que inicia la formación de coágulos de sangre, es un representante importante de esta clase.
Las fuerzas mecánicas necesarias para activar proteínas como el FvW son a menudo tan pequeñas que su magnitud no podría determinarse con los métodos existentes. Ahora, un equipo de científicos dirigido por los físicos de la LMU, el Dr. Martin Benoit y el profesor Jan Lipfert, ha desarrollado un procedimiento mucho más sensible. Sus "pinzas magnéticas" pueden cuantificar fuerzas que son 100 veces más pequeñas que el método alternativo comúnmente utilizado actualmente disponible. Como informan Lipfert y sus colegas en la revista PNAS , han empleado la técnica para observar el despliegue de la proteína VWF bajo la influencia de bajas fuerzas mecánicas.
Un enfoque poderoso para estudiar la mecanorregulación es la llamada espectroscopia de fuerza de proteínas. Esto implica tirar de una molécula de proteína individual y observar cómo una fuerza aplicada altera su estructura tridimensional. Hasta ahora, el método de elección para tirar ha sido un microscopio de fuerza atómica, que funciona mejor en el rango de 100 piconewton (pN). "Sin embargo, muchos procesos moleculares son activados por fuerzas que son mucho más débiles que eso, "dice Lipfert." Entonces, para las mediciones a nivel de moléculas individuales, necesitamos instrumentación más sensible; no tiene mucho sentido usar una báscula de baño para pesar los ingredientes de un pastel ".
Los investigadores desarrollaron un método en el que las proteínas se unen en un extremo a una superficie de vidrio y llevan una etiqueta en el otro extremo que se une a pequeñas perlas magnéticas y luego el conjunto se somete a un campo magnético externo. La extensión de la proteína inducida por el campo da como resultado el desplazamiento vertical de cada perla, que puede ser detectado por microscopía. "Este tipo de configuración se conoce como pinzas magnéticas, "Explica Lipfert." Tiene la gran ventaja de que nos permite aplicar y resolver fuerzas muy débiles, significativamente menos de 1 piconewton, a la proteína de interés. Además, las pinzas magnéticas permiten mediciones muy estables durante largos períodos de tiempo, hasta una semana ".
Para probar el nuevo método, el grupo LMU utilizó VWF como su proteína diana. En el torrente sanguíneo El VWF circula como un multímero de dímeros que están formados por dos subunidades idénticas. En condiciones normales de flujo sanguíneo, tiene una forma globular relativamente compacta. Sin embargo, cualquier aumento de las fuerzas de cizallamiento en el torrente sanguíneo debido a una lesión de la vasculatura provoca el despliegue del vWF. Esto expone los sitios de unión para los receptores en las plaquetas sanguíneas. La unión del VWF a las plaquetas, a su vez, desencadena una cascada de reacciones que conduce a la coagulación. que sella la herida. “La cascada es inducida por la acción sobre la molécula de fuerzas mecánicas que actúan mucho más débiles que las que se han medido hasta ahora, "dice Lipfert. El análisis de la descompresión de los dímeros del VWF con pinzas magnéticas mostró que el llamado tallo del VWF se abre bajo una fuerza aplicada de menos de 1 pN, cuando las subunidades del dímero se separan como las dos mitades de una cremallera. "Suponemos que este patrón de comportamiento, que pudimos observar por primera vez, representa el primer paso en la coagulación sanguínea, ", dice Lipfert." Nuestro enfoque proporciona una imagen detallada de las fuerzas y los cambios en la extensión implicados en el desarrollo de la proteína. Confiamos en que la aplicación futura del método contribuirá a una mejor comprensión del modo de acción del FvW y del papel de las mutaciones clínicamente relevantes.