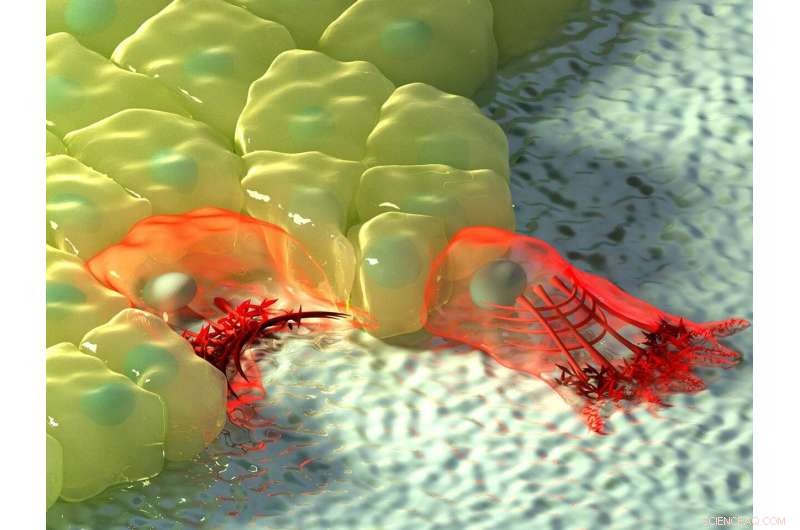
La figura de arriba muestra una ilustración artística de células en regiones de curvatura negativa (izquierda) y positiva (derecha). En curvatura negativa, el flujo de actina se mueve hacia el cable de actina en el borde de la celda, representado por el aumento de la intensidad del color, y el cable contráctil levanta el borde por encima del sustrato. En curvatura positiva, lamellipodia se extienden desde la célula para arrastrarse a lo largo del sustrato, y estas protuberancias se caracterizan por un flujo de actina retrógrado hacia el interior de la célula. Crédito:Instituto de Mecanobiología, Universidad Nacional de Singapur
Cuando se enfrenta a un terreno difícil, Los vehículos todoterreno pueden cambiar de tracción en dos a cuatro ruedas para seguir avanzando. Similar, La migración celular puede ser impulsada por un rastreo dirigido por protuberancias, o por fuerzas de tracción contráctiles, pero cómo cambia la célula entre estos dos métodos sigue siendo un misterio. Un estudio colaborativo dirigido por el estudiante de doctorado de MBI Tianchi Chen y el profesor Benoit Ladoux del Instituto de Mecanobiología (MBI) de la Universidad Nacional de Singapur, ha descubierto que la dirección en la que fluyen los filamentos de actina dentro de la célula le permite sentir la curvatura física de su entorno, y este flujo direccional es el interruptor clave que determina qué método de migración se selecciona. El trabajo fue publicado en la edición de abril de 2019 de Física de la naturaleza .
Reorganización inducida por curvatura del flujo de actina
La migración celular es un proceso biológico esencial que impulsa la formación de tejidos y órganos durante el desarrollo del embrión. y también ayuda a proteger el cuerpo a través de la respuesta inmune y los mecanismos de curación de heridas. Los cambios de forma necesarios para la migración celular dependen de la organización dinámica y la generación de fuerza a partir del citoesqueleto de actomiosina interno de la célula. que se compone de filamentos de actina estructurales y proteínas motoras contráctiles de miosina.
La reorganización de estos componentes permite dos mecanismos de migración celular:el crecimiento y la extensión de protuberancias lamelipoideas basadas en actina que permiten que la célula se 'arrastre' hacia afuera, o la formación de grandes cables contráctiles de actomiosina que pueden tirar de la célula hacia adelante mientras generan fuerzas de tracción sobre el sustrato. Sin embargo, el proceso por el cual la célula elige formar protuberancias o cables contráctiles sigue sin estar claro.
Dependiendo de la topografía del entorno físico, las células pueden encontrar regiones de curvatura positiva o negativa. La curvatura positiva se refiere a una forma convexa que se curva hacia afuera, como una letra mayúscula 'D', mientras que un ejemplo de la curvatura negativa opuesta se puede ver en la letra 'C', que forma una forma cóncava que se curva hacia adentro. Al observar la migración de células epiteliales en patrones de sustrato en forma de flor que se utilizan para ensayos de cierre de heridas, un internacional, equipo de investigación multidisciplinario dirigido por el profesor Ladoux en colaboración con los investigadores principales del MBI, el profesor asociado Boon Chuan Low y el profesor asociado Yusuke Toyama, junto con físicos teóricos y colegas investigadores en Francia, Chile, Israel y España encontraron que en las regiones de curvatura positiva, las células desarrollaron lamelipodia para el rastreo celular, y en regiones de curvatura negativa, cables de actina fuertes ensamblados que seguían el borde cóncavo.
La observación adicional de la dinámica de la actina en tiempo real utilizando microscopía de células vivas reveló una diferencia en la dirección del flujo de actina en las dos curvaturas. En lamelipodia inducida por curvatura positiva, el flujo de actina fue retrógrado, es decir, lejos de la membrana celular en la dirección opuesta a la protuberancia. En cambio, en curvaturas negativas, el flujo de actina era anterógrado, es decir, hacia la membrana celular donde se encontraba el cable de actina.
Este flujo anterógrado impulsa el ensamblaje de distintos, estructuras de actina polarizadas en estas regiones de curvatura negativa. El cable de actina en el borde cóncavo se encuentra en la parte delantera, seguido de fibras transversales de actina que están orientadas en la misma dirección que el cable de actina, y en la parte posterior de la red hay fibras de actina radiales orientadas a 90 grados con respecto al cable de actina. Curiosamente, Se observó la formación de estas estructuras de actina polarizadas en respuesta a la curvatura negativa en células individuales y láminas de células que migran en una superficie 2-D, y en células incrustadas en redes fibrosas tridimensionales. Si bien estos resultados confirmaron la existencia de dos mecanismos de migración celular, Todavía quedaba una pregunta abierta sobre cómo las células podían sentir la curvatura del entorno.
Afortunadamente, las imágenes de células vivas proporcionaron a los investigadores una pista potencial:el cambio en la dirección del flujo de actina en función de la curvatura podría ser el "sensor" para cambiar el modo de migración. Esto se confirmó colocando células epiteliales en una superficie con micropatrón recubierta con un sustrato adhesivo, que estaba salpicado de parches circulares no adherentes. Cuando la hoja de la celda encontró un círculo no adherente, protuberancias lamelipodiales se arrastran alrededor del círculo, tirando de las células hacia adelante sobre el sustrato adhesivo. Esto creó automáticamente una forma cóncava a través del círculo no adherente, que provocó un cambio rápido en la dirección del flujo de actomiosina de retrógrado a anterógrado, resultando en el montaje de un cable de actina y un interruptor en el mecanismo de migración. El cable contráctil puede levantar el borde de la celda sobre el círculo no adherente, permitiendo que continúe la migración de la hoja celular.
Si bien las células contienen sensores de curvatura en su membrana, como las proteínas BAR, estos solo permiten la detección de curvaturas a nivel molecular. Esencialmente, el tamaño de estas proteínas sensoras significa que solo pueden detectar la curvatura en su vecindad inmediata a una escala de nanómetros, no al nivel de la célula completa. Sin embargo, este estudio revela cómo las células pueden detectar cambios de curvatura de mayor tamaño de célula a una escala de hasta decenas de micrómetros, a través de la adaptación dinámica del flujo de actina.
Esta capacidad permite a la célula seleccionar un mecanismo apropiado para continuar con la migración. incluso ante diversos cambios en el entorno físico, muy parecido a cómo un vehículo todoterreno puede cambiar entre tracción en dos y cuatro ruedas dependiendo del terreno. Con el nuevo conocimiento de este interruptor de flujo de actina, los científicos pueden comprender mejor cómo las células pueden continuar la migración durante la cicatrización de heridas, o en situaciones en las que la migración puede ser perjudicial, como la progresión metastásica del cáncer.