
Imagen de los investigadores, presentando (de izquierda a derecha):Dr. Hen Dotan, Avigail Landman, Prof. Avner Rothschild, Prof. Gideon Grader. Crédito:Chen Galili, Departamento de Portavoces del Technion.
La producción de hidrógeno electrolítico implica la generación de hidrógeno a partir del agua utilizando energía eléctrica, que idealmente debería provenir de fuentes de energía renovables como la luz solar y el viento. Aunque este método de producción de hidrógeno podría ser una solución muy prometedora para aumentar la sostenibilidad, pero los investigadores deberán superar varios desafíos clave para que se generalice.
En un estudio reciente presentado en Energía de la naturaleza , un equipo de investigadores del Technion-Israel Institute of Technology ha abordado algunos de estos desafíos, presentando una nueva técnica para dividir el agua que podría mejorar los métodos de producción de hidrógeno electrolítico existentes. Su investigación se inspira en uno de sus estudios anteriores sobre la división del agua fotoelectroquímica (PEC), en el que intentaron combinar la energía solar y la (foto) electrólisis del agua para generar hidrógeno a partir de la luz solar y el agua.
Uno de los mayores desafíos descritos en este trabajo anterior fue la recolección de gas hidrógeno de millones de celdas PEC distribuidas en el campo solar. En su estudio, los investigadores del Technion intentaron desarrollar una técnica que pudiera abordar eficazmente este desafío.
"Tomando las plantas solares fotovoltaicas (PV) como escenario base, la granja solar está compuesta por millones de células fotovoltaicas individuales, donde la corriente (y el voltaje) se recolecta de todos y cada uno de ellos en una rejilla metálica, "Avner Rothschild, uno de los investigadores que realizó el estudio, dijo a TechXplore. "Esto es fácil con la electricidad, pero no así con el gas hidrógeno ".
En una planta solar PEC ideal del futuro, Las células fotovoltaicas serían reemplazadas por células PEC, que puede producir hidrógeno en un componente conocido como compartimento catódico, y oxígeno en una cámara separada llamada compartimento anódico. Estos dos compartimentos deben estar separados, al menos por una membrana, para asegurar que el hidrógeno y el oxígeno no se mezclen, ya que esto provocaría una explosión. Además, el gas hidrógeno debe recogerse de cada celda individual.
Hasta ahora, la creación de esta configuración ha demostrado ser técnicamente difícil y costosa, ya que requiere un colector de tuberías muy costoso. Por último, esto ha hecho que la realización de soluciones para la producción de hidrógeno a gran escala mediante la división del agua PEC sea poco realista.
"Buscamos una salida a este desafío, y se le ocurrió la idea de separar los compartimentos de oxígeno e hidrógeno en la celda PEC en dos celdas separadas, para que el oxígeno se genere en el campo solar y se libere a la atmósfera, mientras que el hidrógeno se genera en un reactor central en la esquina del campo, ", Dijo Rothschild." La separación en dos celdas es posible mediante la inserción de otro conjunto de dos electrodos, llamados electrodos auxiliares, que están siendo cargados y descargados simultáneamente por OH - iones involucrados en la reacción de división del agua, mediando así el intercambio de iones entre las dos células (que es necesario para cerrar el circuito eléctrico) ".
En su artículo anterior, publicado en Materiales de la naturaleza , Rothschild y sus colegas presentaron un nuevo enfoque disruptivo para las arquitecturas de electrólisis del agua (electrolizadores) y fotoelectrólisis (PEC). Este enfoque prometedor, sin embargo, introdujo otro desafío de regenerar los electrodos auxiliares cuando se saturan al final de un ciclo de producción. Los investigadores sugirieron que los electrodos podrían intercambiarse al final de cada ciclo, pero esto sería bastante engorroso, por lo que continuaron explorando soluciones alternativas.
"Luego descubrimos que cuando se calienta el electrodo auxiliar en la celda de hidrógeno, después de que fue acusado (para convertirse en NiOOH), libera burbujas de gas de oxígeno de forma espontánea y se regenera a su estado inicial (Ni (OH) 2 ), ", Dijo Rothschild." Este descubrimiento condujo al desarrollo del proceso de división de agua E-TAC que se presenta en el presente trabajo ".
E-TAC, la nueva técnica de división del agua propuesta por Rothschild y sus colegas, tiene una alta eficiencia energética del 98,7 por ciento, por lo tanto, supera significativamente a los electrolizadores convencionales, que normalmente tienen una eficiencia energética de ~ 70 a 80 por ciento para dispositivos de última generación. Otra ventaja de E-TAC es que produce hidrógeno y oxígeno de forma secuencial, mientras que en la mayoría de los otros electrolizadores, se producen simultáneamente. Esto finalmente elimina la necesidad de una membrana que separe los gases de hidrógeno y oxígeno, simplificando así enormemente la construcción y montaje de las celdas, así como su operación y mantenimiento.
"Potencialmente, esto podría traducirse en grandes ahorros en costos de capital y operación, conduciendo al desarrollo de una tecnología rentable de separación de agua que puede competir con SMR (reformado con vapor de metano), ofreciendo hidrógeno barato sin CO 2 emisiones, siempre que la electricidad provenga de fuentes renovables como la energía hidroeléctrica, energía solar o eólica, "Dijo Rothschild.
En la electrólisis de agua convencional, El hidrógeno y el oxígeno siempre se producen simultáneamente en los compartimentos del cátodo y del ánodo, respectivamente. Los compartimentos se colocan lo más cerca posible entre sí, para minimizar las pérdidas óhmicas eléctricas, y están separados por una membrana para evitar la creación de un explosivo H 2 / O 2 mezcla.
"El cátodo reduce el agua, generando hidrógeno (H 2 moléculas) e iones de hidróxido (OH - ) a través de una reacción conocida como HER (reacción de desprendimiento de hidrógeno), ", Dijo Rothschild." El OH - los iones migran al ánodo a través del electrolito y a través de la membrana, donde se oxidan a través de los REA (reacción de desprendimiento de oxígeno). Juntos, estas dos reacciones (HER y OER) completan la reacción de división del agua:2H 2 O 2H 2 + O 2 . "
En la electrólisis de agua convencional, las dos reacciones electroquímicas descritas por Rothschild están acopladas tanto en el tiempo como en el espacio, ya que ocurren simultáneamente, en la misma celda y muy cerca. Es más, estas características son las mismas si el proceso se aplica a electrolizadores alcalinos o PEM.
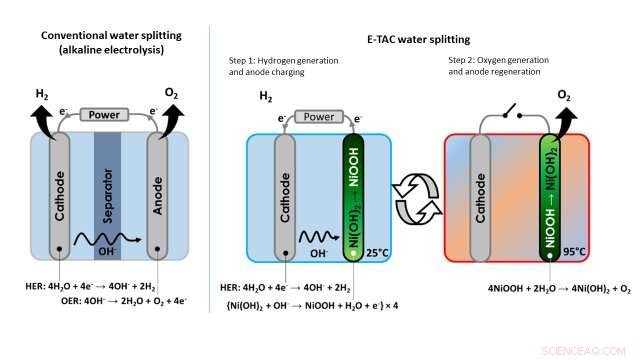
Imagen que muestra la diferencia entre el enfoque convencional para la división del agua (electrólisis alcalina) y la técnica de división del agua E-TAC propuesta por los investigadores. Crédito:Dotan et al.
A diferencia de este enfoque tradicional de la electrólisis del agua, el proceso de división del agua ideado por los investigadores desacopla las reacciones HER y OER, que en cambio ocurren en diferentes momentos y potencialmente en diferentes partes de un dispositivo. En lugar de ser continuo, por lo tanto, E-TAC puede describirse como un 'proceso por lotes' con dos ciclos, el primero genera hidrógeno electroquímicamente y el segundo oxígeno a través de una reacción química espontánea.
"Colocamos el cátodo (el mismo cátodo que se usa en la electrólisis alcalina) y el ánodo (que es diferente del ánodo en la electrólisis convencional) en una celda electrolítica y pasamos corriente entre ellos, ", Dijo Rothschild." El cátodo genera hidrógeno a través de la reacción de HER, al igual que en el caso de la electrólisis de agua convencional, pero el ánodo hace algo completamente diferente. El ánodo esencialmente se carga absorbiendo el OH - iones que se generan en el cátodo, y se transforma gradualmente de Ni (OH) 2 (hidróxido de níquel) a NiOOH (oxihidróxido de níquel) ".
Curiosamente, la reacción que se produce en el ánodo es la misma que se produce en el cátodo de las baterías alcalinas (por ejemplo, baterías de Ni-MH) mientras se cargan. Esto sugiere que puede funcionar bien durante muchos ciclos, tal como lo hace con las pilas alcalinas.
Algunas veces, sin embargo, la carga del ánodo en el proceso E-TAC debe interrumpirse, porque si se sobrecarga, podría empezar a generar oxígeno. Cuando la carga supera un cierto nivel, por lo tanto, los investigadores deben limitar el voltaje aplicado a las células para evitar posibles explosiones derivadas de la cogeneración de oxígeno e hidrógeno.
"Para continuar con el proceso E-TAC, luego necesitamos regenerar el ánodo cargado (NiOOH) a su estado inicial (Ni (OH) 2 ), ", Explicó Rothschild." Lo hacemos elevando su temperatura, thereby accelerating the rate of the spontaneous chemical reaction between the charged anode and water, which releases oxygen and regenerates the anode back to its initial state."
The technique devised by Rothschild and his colleagues thus entails the use of heat to control the chemical reaction that generates oxygen, as the rate of the reaction slows down at low temperatures and accelerates at high temperatures. The generation of hydrogen occurs at a low or ambient temperature, and the generation of oxygen at high temperatures around 95 degrees Celsius. This is why the researchers decided to call it the E-TAC process, which stands for electrochemical-thermally activated chemical process.
"In the proof-of-concept lab tests presented in our article, we manually moved the anode from the cold cell (i.e. a glass beaker filled with alkaline aqueous solution at ambient temperature) to the hot cell (i.e. the same type of beaker, but heated to 95 degrees Celsius), so the separation between hydrogen and oxygen generation was not only in time but also in place, " Rothschild explained. "However, in a real-world industrial system, we foresee a different scenario in which the two electrodes (anode and cathode) and stationary (not moving), whereas the cell in which they are is filled sequentially with cold or hot electrolyte solutions."
Separating the production of hydrogen and oxygen, which removes the need for a membrane separating the two different chambers inside electrolytic cells, results in substantial savings over traditional electrolysis approaches. De hecho, sealing the membrane is generally expensive and also complicates the overall production process. The membrane in conventional systems requires high-purity water and ongoing maintenance, all of which are unnecessary in E-TAC.
Además, the technique devised by Rothschild and his colleagues entirely eliminates the risk of volatile encounters between oxygen and hydrogen, as well as resulting explosions. In traditional systems, por otra parte, this risk is still present, as the membrane could rip or its seal could break.
"En la actualidad, the use of membranes also limits the pressure in hydrogen production, " Rothschild said. "E-TAC renders the membrane unnecessary, thus facilitating hydrogen production under much higher pressure and eliminating some of the high costs of compressing the hydrogen later. Es más, in the new process we proposed, oxygen is produced via a spontaneous chemical reaction between the charged anode and the water, without using an electrical current. This reaction eliminates the need for electricity during oxygen production and increases energetic efficiency from ~70 to 80 percent using customary methods to an unprecedented 98.7 percent."
The technique developed by Rothschild and his colleagues could lower operating costs of sustainable hydrogen production and equipment costs. The researchers have estimated that the production costs for equipment based on E-TAC would be approximately half of those for existing technologies.
"The process we invented presents a conceptual breakthrough in water splitting, and in view of the advantages it offers, it may become a game-changer and lead to a new technology for hydrogen production from water without CO 2 emissions, which could compete with SMR to produce clean hydrogen and enable the transition from fossil fuels to clean hydrogen fuel, " Rothschild said.
After they finished writing their paper, the researchers at Technion patented their invention and founded a start-up called H 2 Pro, with the mission of developing and distributing new water splitting technology based on the E-TAC technique. They hope to soon commercialize this technology by scaling-up the electrodes and cells used in their study, constructing and testing hydrogen generators based on the E-TAC water-splitting process, optimizing their operation scheme and examining high-pressure hydrogen production.
"We also plan to carry out further academic research to study new electrode materials and apply advanced analytical methods to understand the correlations between electrode composition and microstructure and its function properties, in order to develop the next generation of Ni(OH) 2 -based electrodes for our E-TAC water-splitting process, " Rothschild said. "Our goal is to improve their capacity (so that we can run longer processes) with fast charging and regeneration rates to enable high hydrogen production rates."
© 2019 Science X Network