Investigadores de la Universidad de Kanazawa informan en el Journal of Physical Chemistry Letters estudios de microscopía de fuerza atómica de alta velocidad que arrojan luz sobre el posible papel de la proteína del marco de lectura abierto 6 (ORF6) en los síntomas de COVID-19.
Si bien muchos países de todo el mundo están experimentando un respiro de la intensa propagación de las infecciones por SARS-CoV-2 que provocaron niveles trágicos de enfermedad y múltiples cierres nacionales a principios de la década, los casos de infección persisten.
Una mejor comprensión de los mecanismos que sustentan el virus en el cuerpo podría ayudar a encontrar tratamientos más eficaces contra las enfermedades causadas por la enfermedad, así como proteger contra futuros brotes de infecciones similares. Teniendo esto en cuenta, ha habido mucho interés en las proteínas accesorias que produce el virus para ayudarle a prosperar en el cuerpo.
"Al igual que otros virus, el SARS-CoV-2 expresa una serie de proteínas accesorias para reprogramar el entorno del huésped para favorecer su replicación y supervivencia", explican Richard Wong de la Universidad de Kanazawa y Noritaka Nishida de la Universidad de Chiba y sus colegas en este último informe. informe. Entre esas proteínas accesorias se encuentra ORF6.
Estudios anteriores han sugerido que ORF6 interfiere con la función del interferón 1 (IFN-I), un tipo particular de pequeña proteína utilizada en el sistema inmunológico, lo que puede explicar los casos de infección asintomática con SARS-CoV2. También hay evidencia de que ORF6 provoca la retención de ciertas proteínas en el citoplasma al tiempo que interrumpe el transporte de ARNm desde la célula, lo que puede ser un medio para inhibir la señalización de IFN-I. Sin embargo, el mecanismo de esta retención de proteínas y la interrupción del transporte no estaba claro.
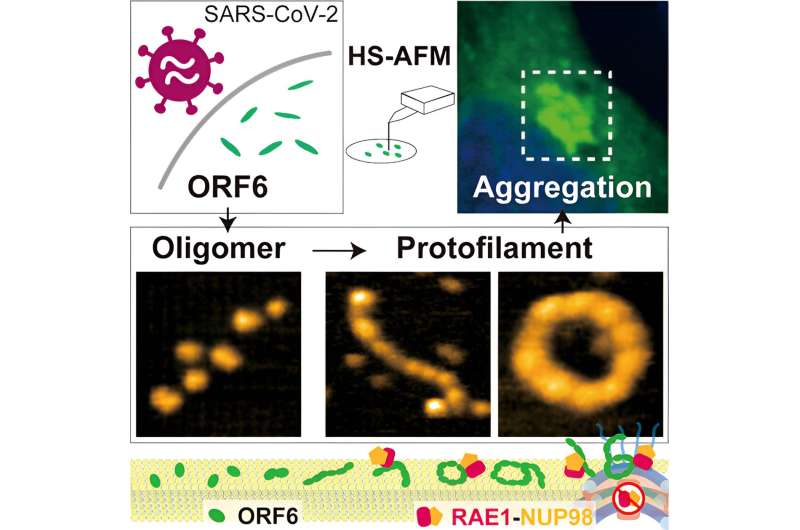
Para arrojar luz sobre estos mecanismos, los investigadores primero examinaron qué pistas podrían dar varios programas de software sobre la estructura de ORF6. Estos indicaron la probable presencia de varias regiones intrínsecamente desordenadas. Las mediciones de resonancia magnética nuclear también confirmaron la presencia de un segmento desordenado muy flexible.
Aunque el algoritmo de aprendizaje automático AlphaFold2 ha demostrado ser muy útil para determinar cómo se pliegan las proteínas, la presencia de estas regiones intrínsecamente desordenadas limita su uso para establecer la estructura de ORF6, por lo que los investigadores utilizaron microscopía de fuerza atómica de alta velocidad (HS-AFM), que es capaz de identificar estructuras detectando la topografía de las muestras de la misma manera que la aguja de un tocadiscos atraviesa los surcos del vinilo.
Utilizando HS-AFM, los investigadores establecieron que ORF 6 tiene principalmente la forma de filamentos elipsoidales de oligómeros:cadenas de unidades moleculares repetidas pero más cortas que los polímeros. La longitud y circunferencia de estos filamentos fue mayor a 37°C y mínima a 4°C, por lo que la presencia de fiebre podría ser beneficiosa para producir filamentos más grandes. Los sustratos compuestos de lípidos (compuestos grasos) también fomentaron la formación de oligómeros más grandes.
Debido a que HS-AFM captura imágenes tan rápidamente, fue posible captar no solo las estructuras sino también algunas de las dinámicas del comportamiento de ORF6, incluido el movimiento circular, el ensamblaje de proteínas y el volteo. Además, análisis informáticos adicionales también revelaron que los filamentos eran propensos a agregarse en amiloides, como se encuentra en algunas enfermedades neurodegenerativas, y que pueden provocar complicaciones en los síntomas de COVID-19. Como señalan los investigadores, esta agregación funciona "para secuestrar eficazmente una gran cantidad de proteínas del huésped, en particular factores de transcripción implicados en la señalización del IFN-I".
Dado que estos filamentos se rompen en presencia de ciertos alcoholes, urea o dodecilsulfato de sodio, Wong, Nishida y sus colegas concluyen que la proteína se mantiene unida en gran medida mediante interacciones hidrofóbicas. "Los posibles candidatos farmacológicos que disocian los agregados de ORF6 interrumpiendo las interacciones hidrofóbicas deben considerarse y probarse en un futuro próximo para evaluar su valor terapéutico en el manejo y tratamiento de la COVID-19", afirman los investigadores.
Más información: Goro Nishide et al, Elucidación nanoscópica del autoensamblaje espontáneo de la proteína del marco de lectura abierto 6 (ORF6) del coronavirus 2 del síndrome respiratorio agudo severo (SARS-CoV-2), The Journal of Physical Chemistry Letters (2023). DOI:10.1021/acs.jpclett.3c01440
Información de la revista: Revista de cartas de química física
Proporcionado por la Universidad de Kanazawa