La acidificación de los océanos, la respiración de los mamíferos y la formación de aerosoles dependen de la química que se produce en las interfaces aire-agua. En una nueva investigación, científicos del Laboratorio Nacional Lawrence Berkeley (Berkeley Lab) del Departamento de Energía han descubierto qué vía conduce el dióxido de carbono (CO2 ) las moléculas siguen su camino desde la atmósfera hacia el agua, y no es el que esperaban.
Los océanos absorben aproximadamente el 30% de todo el CO2 antropogénico emisiones. En el agua, el CO2 forma ácido carbónico, cambiando el ambiente marino de maneras que son perjudiciales para algunas especies de vida marina. En nuestro cuerpo, el aire que cruza las membranas húmedas que recubren nuestros tractos nasales influye en el pH de nuestra sangre.
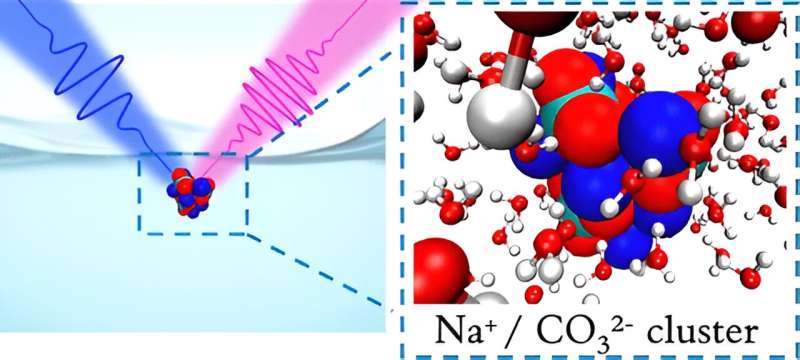
Pero cómo cambia la química local depende de cómo el CO2 disuelto se separa en dos iones diferentes con diferentes cargas (carbonato doblemente cargado y bicarbonato con carga simple) cerca de la superficie del líquido. Los investigadores del Laboratorio de Berkeley ahora muestran una mayor concentración de carbonato en las interfaces aire-agua, donde esperaban encontrar más bicarbonato.
"El ciclo del carbono de la Tierra, así como el ciclo respiratorio de los mamíferos, implica explícitamente la disolución del CO2 en la superficie del agua y su transformación en iones bicarbonato y carbonato. Comprender las reacciones en la interfaz aire-agua iluminará aún más estos procesos de vital importancia", afirmó Jin Qian, investigador que contribuyó con la parte teórica del trabajo publicado en el Journal of the American Chemical Society. . Qian es científico del personal de la División de Ciencias Químicas del Laboratorio de Berkeley.
Los procesos químicos que ocurren en una interfaz líquido-aire a menudo son distintos de los mismos que ocurren en el líquido a granel correspondiente. La teoría clásica de los libros de texto indica que el carbonato debe permanecer en el líquido a granel, mientras que el bicarbonato debe concentrarse en la superficie; pero no está clara una comprensión detallada de las rutas de los dos iones. Debido a que la superficie de una solución comprende solo una pequeña fracción de su volumen total, medir las concentraciones de iones allí es difícil.
"La señal no sólo es muy débil, sino que debe separarse de la respuesta masiva mucho mayor del sistema", explicó Richard Saykally, profesor del Departamento de Química de UC Berkeley, quien dirigió el trabajo. Saykally es un científico docente jubilado de la División de Ciencias Químicas del Laboratorio de Berkeley.
Saykally y sus colegas utilizaron herramientas especialmente diseñadas para medir señales químicas débiles en superficies líquidas. La técnica, llamada espectroscopia de generación de segundo armónico UV profundo (DUV-SHG), sondea directamente los iones en las interfaces líquidas.
"Ahora podemos medir las poblaciones superficiales relativas de carbonato y bicarbonato, así como información termodinámica sobre su afinidad superficial", dijo Shane Devlin, investigador postdoctoral en el Laboratorio de Berkeley y autor principal del estudio. El equipo descubrió que el carbonato exhibía una tendencia mucho más fuerte a adherirse a la superficie que el bicarbonato.
Para explicar este comportamiento tan inesperado, los investigadores recurrieron a herramientas teóricas. Tod Pascal y sus colegas de UC San Diego realizaron simulaciones por computadora para comprender cómo los iones de carbonato y bicarbonato forman grupos, un proceso que probablemente fue responsable de sus diferentes concentraciones en la superficie y en el líquido a granel.
Descubrieron que, si bien la agrupación era un proceso favorable para el carbonato, no lo era para el bicarbonato. Para explicar con más detalle las observaciones de espectroscopia, Qian y su grupo realizaron simulaciones utilizando el sistema Perlmutter en el Centro Nacional de Computación Científica de Investigación Energética (NERSC), una instalación para usuarios del DOE en el Laboratorio de Berkeley. Desarrollaron un método que permitió calcular las huellas espectrales de carbonato y bicarbonato en una región muy grande en la interfaz líquido-aire.
Las simulaciones confirmaron que el carbonato efectivamente muestra una preferencia mucho más fuerte por la interfaz aire-agua. Fue el resultado del fuerte emparejamiento del carbonato con iones de sodio, lo que dio lugar a grupos neutros de partículas que luego fueron atraídas hacia la superficie.
"Esta es la primera vez que nuestro método computacional se utiliza en un entorno de aplicación realista, estudiando la interfaz aire-líquido que contiene alrededor de mil átomos", dice Qian.
Si bien es sorprendente, la medición puede tener implicaciones de gran alcance. La superficie del océano es donde el aire y el agua se mezclan, lo que lleva a la formación de gotas de aerosol, que desempeñan un papel esencial en el clima global y los patrones atmosféricos.
Como el nivel de CO2 atmosférico Si continúa aumentando, la proporción de aniones carbonato y bicarbonato en la superficie probablemente cambiará, lo que a su vez influirá en la química de las gotas de aerosoles marinos. Comprender el impacto potencial del aumento de las concentraciones de carbonato en los aerosoles es importante para los científicos que trabajan para predecir el cambio climático.
Además, el bicarbonato es un ion relativamente suave y puede servir como un amortiguador fisiológico que ayuda a nuestra sangre y tejidos a mantener una función química y metabólica adecuada. Por el contrario, el carbonato es simplemente demasiado fuerte para servir como amortiguador. Comprender cómo cambian estos equilibrios podría ser importante para una descripción exhaustiva de la respiración en los mamíferos.
"El comportamiento interfacial de estas especies y procesos impacta directamente tanto en los ciclos geofísicos como biológicos. Los hallazgos de este estudio motivarán esfuerzos futuros destinados a determinar las consecuencias para la ecología marina", dijo Saykally.
Más información: Shane W. Devlin et al, La aglomeración impulsa el fraccionamiento inverso de carbonato y bicarbonato acuoso en la interfaz aire-agua, Revista de la Sociedad Química Estadounidense (2023). DOI:10.1021/jacs.3c05093
Información de la revista: Revista de la Sociedad Química Estadounidense
Proporcionado por el Laboratorio Nacional Lawrence Berkeley