Se han dirigido intensos esfuerzos de investigación al estudio de la conversión electroquímica del CO2. , un importante gas de efecto invernadero, en productos químicos y combustibles para plataformas. El éxito de esta tecnología puede permitir la descarbonización de algunas de las mayores emisiones de CO2. emisores, incluidas las industrias de fabricación de acero, cemento y productos químicos.
El cobre es único en su capacidad de convertir CO2 a bajas temperaturas hasta una amplia gama de productos, como monóxido de carbono, etileno y etanol en densidades de corriente industrialmente viables. Como resultado, existe un interés generalizado en comprender el CO2 conversión en electrodos de cobre como CO2 eficiente y estable electrolizadores.
En un estudio reciente en el que participó un equipo multidisciplinario del Laboratorio Nacional Lawrence Livermore (LLNL), el Laboratorio Nacional Lawrence Berkeley, la Universidad de California Berkeley y el Instituto Avanzado de Ciencia y Tecnología de Corea (KAIST), los investigadores utilizaron modelos microcinéticos y cinéticos transitorios químicos. comprender el funcionamiento a escala atomística de los electrodos de cobre durante la conversión electroquímica del monóxido de carbono, una reacción intermedia clave en el CO2 electroquímico. conversión.
Sus hallazgos se publicaron como un artículo de acceso abierto en la revista ACS Catalysis. .
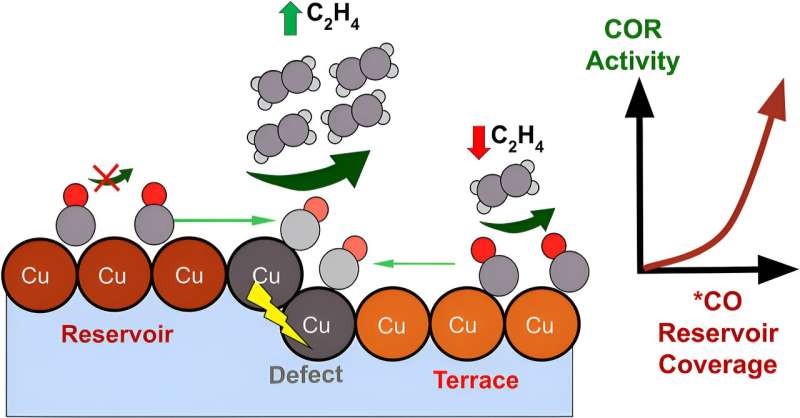
Utilizando un protocolo experimental simple que implica el cambio repetido de la alimentación de gas de argón a monóxido de carbono, los investigadores encuentran que la conversión de monóxido de carbono a productos de múltiples carbonos puede ocurrir al mismo ritmo durante varios segundos incluso después de que la alimentación de gas se cambia de monóxido de carbono a argón. (denominado tiempo de retraso). Esta observación motivó al equipo a comprender el origen del tiempo de retraso y sus implicaciones para diseñar catalizadores eficientes para esta importante reacción.
"Nuestro sorprendente hallazgo de este trabajo es que la actividad catalítica efectiva de la reacción mejora cuando hay una fracción mayor de sitios menos activos [denominados sitios de reservorio]. Desarrollamos un modelo microcinético que involucra tres tipos de sitios para explicar nuestros hallazgos", dijo Nitish Govindarajan, investigador de LLNL y coautor principal.
"Nuestros hallazgos indican que los sitios activos de catalizadores no se pueden analizar de forma aislada de sus sitios vecinos. Más bien, debemos considerar cómo toda la red de sitios de catalizadores trabaja de manera cooperativa para establecer una cadena de suministro de reactivos a los sitios más activos", dijo el codirector de LLNL. investigador Christopher Hahn.
Más información: Chansol Kim et al, Importancia de la diversidad y conectividad del sitio en la reducción electroquímica de CO en Cu, Catálisis ACS (2024). DOI:10.1021/acscatal.3c05904
Proporcionado por el Laboratorio Nacional Lawrence Livermore