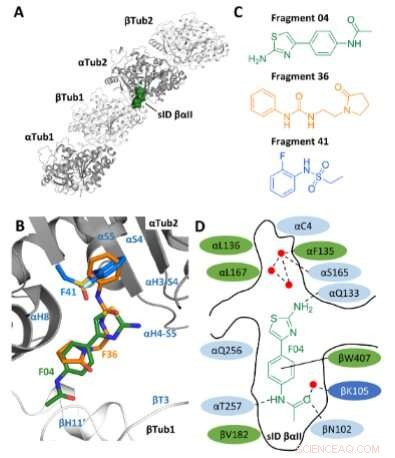
Selección de fragmentos. A) Ubicación del sitio sID βαII (representación de volumen) en la interfaz de interdímero βTub1-αTub2 del T2 complejo R-TTL. Por simplicidad, no se muestran las cadenas RB3 y TTL. Los dos monómeros de tubulina α y dos de β en el T2 El complejo R-TTL se muestra en representación de cinta gris y blanca, respectivamente. B) Superposición de las poses de unión F04, F36 y F41 (ID de PDB 5S4O, 5S5K y 5S5P, respectivamente). Los elementos de la estructura secundaria de la tubulina están etiquetados en azul. Los átomos de carbono están coloreados en verde para F04, naranja para el fragmento F36 y azul claro para el fragmento F41. Los átomos de nitrógeno están coloreados en azul, los átomos de oxígeno en rojo, los átomos de azufre en amarillo y los átomos de flúor en verde claro. C) Estructuras químicas de los fragmentos F04, F36 y F41. D) Representación esquemática de F04 unida al sitio sID βαII. Los residuos que forman el sitio de unión se muestran en verde para hidrofóbicos, en azul claro para polares y en azul oscuro para residuos cargados. Los residuos que interactúan αL242 y αL252 no se muestran porque están ubicados debajo del ligando. Los enlaces de hidrógeno se indican con interacciones discontinuas y de apilamiento π con líneas negras continuas. Los puntos rojos representan moléculas de agua cristalográficas. Crédito:Edición internacional de Angewandte Chemie (2022). DOI:10.1002/anie.202204052
Investigadores del Instituto Paul Scherrer PSI y el Instituto Italiano de Tecnología IIT han desarrollado una sustancia novedosa que desactiva una proteína en el esqueleto celular, lo que lleva a la muerte celular. De esta forma, sustancias de este tipo pueden prevenir, por ejemplo, el crecimiento de tumores. Para lograr esto, los investigadores combinaron un método biológico estructural con el diseño computacional de agentes activos. El estudio apareció en la revista Angewandte Chemie International Edition .
El esqueleto celular, también llamado citoesqueleto, impregna todas nuestras células como una red dinámica de estructuras proteicas similares a hilos. Le da a las células su forma, ayuda en el transporte de proteínas y componentes celulares más grandes y juega un papel crucial en la división celular. El bloque de construcción central es la proteína tubulina. Se organiza en estructuras en forma de tubo, los filamentos de microtúbulos.
Los agentes activos que se adhieren al esqueleto celular se encuentran entre los medicamentos más efectivos contra el cáncer. Bloquean la tubulina y, por lo tanto, evitan la división celular en los tumores. Los investigadores de PSI, en colaboración con el Instituto Italiano de Tecnología en Génova, ahora han desarrollado otra sustancia potente que desactiva la tubulina. Lo han apodado "Todalam".
"Todalam evita que la tubulina se organice en forma de filamentos de microtúbulos", explica el primer autor Tobias Mühlethaler, quien codiseñó y estudió la sustancia como parte de su investigación doctoral en PSI. "La proteína permanece como congelada en una estructura que no encaja en los microtúbulos".
Diseñado racionalmente
Por lo general, existen dos enfoques diferentes para desarrollar nuevos medicamentos:los investigadores pueden probar una enorme cantidad de moléculas para detectar las que parecen prometedoras, o pueden diseñar específicamente moléculas químicas que logren el efecto deseado. Los investigadores de PSI e IIT eligieron el segundo camino, que suele ser más difícil.
Al hacer esto, pudieron construir sobre su propio trabajo preliminar, una investigación en la que ya habían localizado lugares en la tubulina donde las moléculas pueden acoplarse especialmente bien. Estos son los llamados bolsillos de unión, de los cuales encontraron 27. Además, los investigadores identificaron 56 fragmentos que se unen a estos sitios. Este trabajo también se había publicado anteriormente en Angewandte Chemie International Edition .
En el estudio actual basado en este trabajo anterior, los investigadores seleccionaron inicialmente un bolsillo de unión recientemente descubierto en la tubulina. Utilizaron diseño computacional para combinar las estructuras de tres fragmentos moleculares, que preferentemente se acoplan en este punto, en un solo compuesto químico, y luego lo sintetizaron en el laboratorio. "Al combinar los tres fragmentos en una molécula, esperábamos mejorar el efecto, ya que la nueva molécula llena mejor el bolsillo de unión", dice Michel Steinmetz, director del Laboratorio de Investigación Biomolecular de PSI.
Usando mediciones en Swiss Light Source SLS, los investigadores verificaron qué tan bien encaja realmente la molécula en el bolsillo de unión. En dos ciclos más, mejoraron la sustancia hasta llegar a Todalam. "Con una química relativamente simple, logramos llegar a un compuesto potente", dice con orgullo Andrea Prota, científica del grupo de Steinmetz que colaboró estrechamente con Mühlethaler.
Estructura química simple
En cultivos celulares, los investigadores demostraron que Todalam mata las células. No es de extrañar, ya que la tubulina es esencial para la vida. "Cuanto mejor se une una sustancia a un sitio crítico en la tubulina, más tóxica es para las células", explica Steinmetz. Eso convierte a Todalam en un punto de partida prometedor para desarrollar un fármaco.
Los inhibidores del citoesqueleto actualmente en uso clínico son sustancias naturales con estructuras grandes y complejas y, por lo tanto, son difíciles de sintetizar. El compuesto Todalam recientemente desarrollado, por otro lado, se puede producir en una síntesis química simple en el laboratorio. "Eso también significa que el compuesto podría producirse en grandes cantidades con relativa facilidad", subraya Steinmetz. El citoesqueleto celular como diana de nuevos agentes activos