Gráficamente abstracto. Crédito:Química de la naturaleza (2022). DOI:10.1038/s41557-022-00937-w
En cada momento en las células de nuestro cuerpo, se producen innumerables actividades vitales para la vida gracias a las enzimas. Estas proteínas especiales actúan como catalizadores al acelerar el ritmo y mejorar la selectividad de las reacciones químicas sin sufrir cambios permanentes. Más allá de su papel indispensable en la biología, las enzimas también son fundamentales para innumerables procesos en las industrias alimentaria, farmacéutica, agrícola y cosmética.
Contrariamente a su ubicuidad e importancia, las enzimas son poco conocidas. En particular, los científicos quieren saber qué hace que los sitios activos de las enzimas, la región en forma de bolsillo donde tienen lugar las reacciones químicas aceleradas, sean tan poderosos. Mientras que las estructuras atómicas tridimensionales de los sitios activos de muchas enzimas han sido visualizadas y mapeadas, la estructura "invisible" de los campos eléctricos dentro de un sitio activo es mayormente desconocida. Se teoriza que esos campos eléctricos juegan un papel importante en la formación de un entorno preciso en los sitios activos donde las moléculas reaccionan y hacen una transición rápida a nuevas moléculas.
Ahora, un estudio codirigido por los investigadores de Stanford Chu Zheng y Yuezhi Mao ha presentado una nueva sonda para medir y visualizar los campos eléctricos dentro del sitio activo de una enzima. El artículo, publicado recientemente en la revista Nature Chemistry , informa sobre la orientación de los campos eléctricos en el sitio de la reacción y podría ayudar a los investigadores a calcular las interacciones químicas clave en los sitios activos. Estos conocimientos, a su vez, podrían conducir a la creación de enzimas sintéticas personalizadas para la industria, así como a un gran avance en el descubrimiento y diseño de nuevos fármacos que interfieren o modulan la función de los objetivos de las enzimas.
"Hemos desarrollado una nueva sonda que puede brindarnos información importante sobre cómo los campos eléctricos están orientados de manera única en las enzimas, lo que creemos que es fundamental para el asombroso poder catalítico de las enzimas", dijo Zheng, estudiante graduado en el laboratorio de Steven G. Boxer, profesor de química Camille Dreyfus.
"En un nivel básico, estamos tratando de comprender mejor cómo funcionan las enzimas y, en este estudio, estamos agregando una nueva dimensión al incorporar orientaciones de campo eléctrico que se cree que tienen un impacto crítico en las funciones catalíticas de las enzimas", dijo Mao, un erudito postdoctoral en química que trabaja en el laboratorio de Thomas Markland, profesor asociado de química en Stanford y también coautor principal.
Una herramienta nueva y potente
El laboratorio Boxer de Stanford ha sido pionero en el concepto de interpretar la funcionalidad de las enzimas midiendo las interacciones electrostáticas, que están presentes en todas las formas de materia y están organizadas específicamente en tres dimensiones en moléculas biológicas grandes.
"El origen de la asombrosa funcionalidad de las enzimas es una pregunta general, y se aplica no solo a la catálisis biológica sino también a la catálisis química, que es un gran negocio", dijo Boxer. "Aproximadamente el 80 por ciento de todos los productos químicos se fabrican con catalizadores, pero no se comprende bien qué es realmente responsable de reducir la energía libre de activación [para que la reacción ocurra más rápido] para la mayoría de las reacciones. Investigar el papel de los campos eléctricos en la función de las enzimas es muy mucho en el corazón de nuestro trabajo", dijo Boxer, presidente del Departamento de Química de la Facultad de Humanidades y Ciencias de Stanford y coautor principal del estudio.
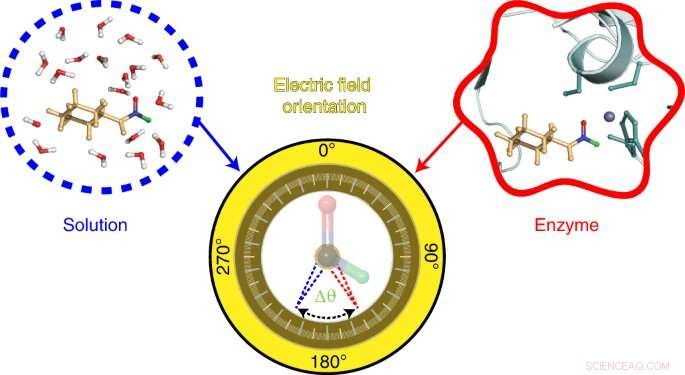
La sonda desarrollada por el equipo de Stanford se basa en una técnica, también desarrollada en el laboratorio de Boxer, llamada espectroscopia de efecto Stark vibracional. Esta técnica mide las frecuencias vibratorias en las moléculas de la sonda en función de la longitud de onda de la luz infrarroja absorbida por sus enlaces químicos. Los cambios en estas frecuencias vibratorias revelan información sobre los campos eléctricos presentes. En este estudio, los investigadores investigaron los cambios en las frecuencias vibratorias de los enlaces químicos en una sonda hecha de una molécula llamada N-ciclohexilformamida. Esta molécula actúa como un inhibidor, uniéndose al sitio activo de una enzima llamada alcohol deshidrogenasa hepática.
To visualize the electric field in the active site of liver alcohol dehydrogenase, the researchers targeted two bonds in the N-cyclohexylformamide probe about 120 degrees away from each other. That specific angle between the two bonds allowed the researchers to gauge not only the strength, or magnitude, of the electric field, but also the field's orientation. Previous studies from the Boxer lab on other enzyme active sites had reported on the magnitude of electric fields but not on their directions.
"We call this tool a two-directional probe because with this probe we can measure the electric field in an active site in two different directions," Zheng said. "Using the probe this way, we can reconstruct and extract the orientation information about the electric field. That hasn't been done in the past."
Gathering this key measurement first required some chemical sleight of hand. One of the N-cyclohexylformamide probe's chemical bonds—between a carbon atom and a hydrogen atom—is notoriously difficult to observe in protein environments. So, the researchers swapped the hydrogen atom for the element's heavier cousin, called deuterium. The new carbon–deuterium bond proved amenable to measurement, and helped the researchers reveal the orientation of the electric field.
A precise enzymatic environment
The Stanford researchers combined their experimental data with computer simulations and quantum mechanical calculations to describe the electric field's interactions with N-cyclohexylformamide, modified with deuterium, at the active site of liver alcohol dehydrogenase. Those properties were then compared to the electric fields found in water, acetone, and other common solvents.
Notably, the researchers found the orientation of the electric field in the active site of liver alcohol dehydrogenase differs considerably from the electric field orientation in the solvents they studied. That result supports the idea that enzyme active sites feature what scientists call a preorganized electrostatic environment, or one in which the precise positioning of amino acids and the electrostatic environment they create help reduce the energy required for a chemical reaction to take place. This could be a key to enzymes' remarkable ability to catalyze reactions.
"With this study, we are helping to advance the concept of correlating the performance of enzymes with both the magnitude and orientation of the electric fields in active sites," Mao said. "What we have found is evidence that electric fields in the enzyme active sites are preorganized, and that is an important clue in solving the mystery of why enzymes have their amazing abilities."
The probe developed by the Stanford researchers could be used to investigate many other enzymes' active sites. Broadening knowledge in this way will bring scientists and engineers closer to being able to design bespoke enzymes with spectacular new characteristics.
"The ultimate goal of this research is to enable us to design enzymes that have superb catalytic performance for biomedical and industrial application," Zheng said. "We are still far from that, but we are making progress and have a better understanding now than before regarding how enzymes work." An enzyme's evolution from changing electric fields and resisting antibiotics