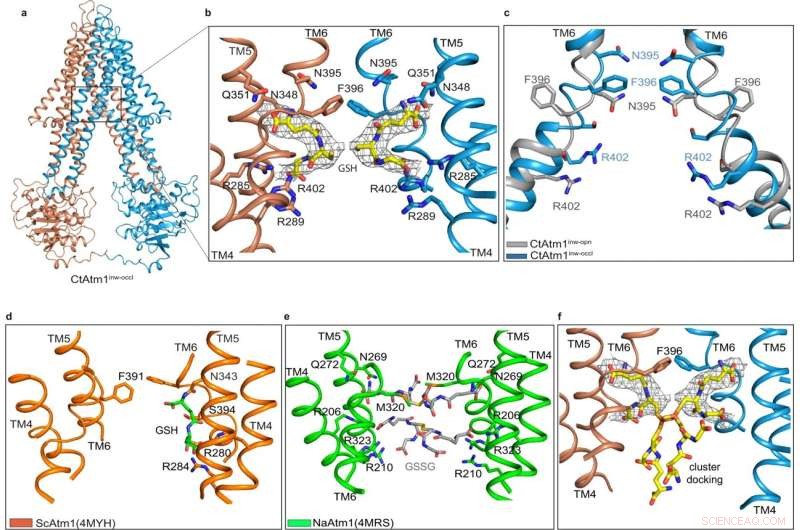
La estructura orientada hacia el interior parcialmente ocluida con carga atada. Crédito:Comunicaciones de la naturaleza (2022). DOI:10.1038/s41467-022-32006-8
Una nueva investigación proporciona una nueva perspectiva sobre cómo se crea y se mueve una clase importante de moléculas en las células humanas.
Durante años, los científicos sabían que las mitocondrias, estructuras especializadas dentro de las células del cuerpo que son esenciales para la respiración y la producción de energía, estaban involucradas en el ensamblaje y movimiento de los cofactores de hierro y azufre, algunos de los compuestos más esenciales en el cuerpo humano. Pero hasta ahora, los investigadores no entendían cómo funcionaba exactamente el proceso.
Nueva investigación, publicada en la revista Nature Communications , descubrió que estos cofactores se mueven con la ayuda de una sustancia llamada glutatión, un antioxidante que ayuda a prevenir ciertos tipos de daño celular al transportar estos cofactores de hierro esenciales a través de una barrera de membrana.
El glutatión es especialmente útil porque ayuda a regular metales como el hierro, que los glóbulos rojos utilizan para producir hemoglobina, una proteína necesaria para ayudar a transportar oxígeno por todo el cuerpo, dijo James Cowan, coautor del estudio y distinguido profesor universitario. emérito en química y bioquímica en el estado de Ohio.
"Los compuestos de hierro son fundamentales para el correcto funcionamiento de la bioquímica celular, y su ensamblaje y transporte es un proceso complejo", dijo Cowan. "Hemos determinado cómo una clase específica de cofactores de hierro se mueve de un compartimento celular a otro mediante el uso de maquinaria molecular compleja, lo que les permite ser utilizados en múltiples pasos de la química celular".
Los grupos de hierro y azufre son una clase importante de compuestos que llevan a cabo una variedad de procesos metabólicos, como ayudar a transferir electrones en la producción de energía y producir metabolitos clave en la célula, además de ayudar en la replicación de nuestra información genética.
"Pero cuando estos grupos no funcionan correctamente, o cuando las proteínas clave no pueden obtenerlos, suceden cosas malas", dijo Cowan.
Si no puede funcionar, la proteína corrupta puede dar lugar a varias enfermedades, incluidas formas raras de anemia, ataxia de Friedreich (un trastorno que causa daño progresivo al sistema nervioso) y una multitud de otros trastornos metabólicos y neurológicos.
Entonces, para estudiar cómo funciona este mecanismo esencial, los investigadores comenzaron tomando un hongo llamado C. thermophilum, identificando la molécula de proteína clave de interés y produciendo grandes cantidades de esa proteína para la determinación estructural. El estudio señala que la proteína que estudiaron dentro de C. thermophilum es esencialmente un gemelo celular de la proteína humana ABCB7, que transfiere grupos de hierro y azufre en las personas, lo que la convierte en el espécimen perfecto para estudiar la exportación de grupos de hierro y azufre en las personas.
Mediante el uso de una combinación de microscopía crioelectrónica y modelado computacional, el equipo pudo crear una serie de modelos estructurales que detallan la vía que utilizan las mitocondrias para exportar los cofactores de hierro a diferentes lugares dentro del cuerpo. Si bien sus hallazgos son vitales para aprender más sobre los componentes básicos de la bioquímica celular, Cowan dijo que está emocionado de ver cómo su descubrimiento podría hacer avanzar la medicina y la terapéutica más adelante.
"Al comprender cómo se ensamblan y mueven estos cofactores en las células humanas, podemos sentar las bases para determinar cómo prevenir o aliviar los síntomas de ciertas enfermedades", dijo. "También podemos utilizar ese conocimiento fundamental como base para otros avances en la comprensión de la química celular". Información estructural sobre la biogénesis de la proteína Fe-S