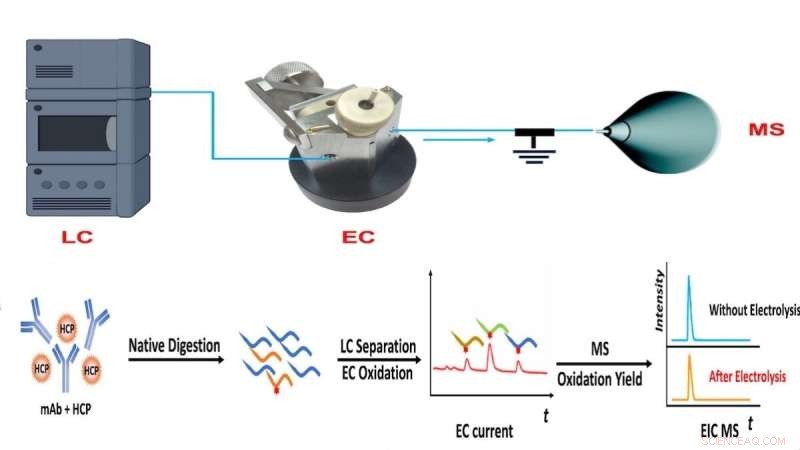
Flujo de trabajo del método CMS del equipo del NJIT, que combina cromatografía líquida (LC), oxidación electroquímica (EC) y medición cuantitativa basada en espectrometría de masas (MS) de la abundancia de proteínas. Crédito:NJIT
Investigadores del Instituto de Tecnología de Nueva Jersey (NJIT) han presentado una nueva técnica de laboratorio que, según dicen, representa un "cambio de paradigma" en la forma en que los laboratorios farmacéuticos prueban y producen nuevos medicamentos basados en proteínas, como los anticuerpos monoclonales terapéuticos que se están desarrollando para tratar una variedad de enfermedades. desde cánceres hasta enfermedades infecciosas.
Los investigadores dicen que su enfoque basado en la electroquímica, descrito en la revista Analytical Chemistry , podría permitir que las pruebas de seguridad y calidad de los bioterapéuticos emergentes se realicen en una fracción del tiempo requerido por los métodos convencionales, que generalmente requieren la producción prolongada y costosa de ciertos biomateriales utilizados para las pruebas de muestra.
El estudio se realizó en colaboración con investigadores de Merck, Johnson &Johnson y la Universidad de Ohio.
"Este método que hemos desarrollado en el NJIT tiene el potencial de tener un gran impacto en la proteómica cuantitativa y representa un cambio de paradigma en la industria farmacéutica en términos de monitoreo de impurezas de procesos y productos biofarmacéuticos para el control de calidad", dijo Hao Chen, director del artículo. autor correspondiente y profesor del Departamento de Química y Ciencias Ambientales del NJIT.
"Con este estudio, ahora hemos demostrado un enfoque que puede cuantificar los productos farmacéuticos y procesar las impurezas de manera mucho más rápida y precisa de lo que había sido posible... Esperamos que sea muy útil para facilitar el desarrollo de vacunas y proteínas terapéuticas para el tratamiento y la prevención de diferentes enfermedades en el futuro".
Tradicionalmente, tales pruebas, o la cuantificación de proteínas, implican la preparación de péptidos marcados con isótopos sintéticos que requieren mucho tiempo y que se utilizan como estándares internos para medir las concentraciones totales de proteínas en una muestra, lo que ayuda a los investigadores a controlar activamente la eficacia y la seguridad de los componentes de las proteínas terapéuticas a lo largo del desarrollo del fármaco. proceso.
Para superar esta limitación, el laboratorio de Chen desarrolló un enfoque de espectrometría de masas culombimétrica (CMS) para la cuantificación absoluta de proteínas sin el uso de estándares. En cambio, el método aplica cromatografía líquida-espectrometría de masas y una celda de flujo electroquímico para cuantificar y detectar rápidamente cambios en las proteínas o péptidos objetivo en función de las firmas electroquímicas.
"En lugar de esperar semanas para obtener estándares o reactivos en los enfoques tradicionales, uno podría realizar experimentos de cuantificación CMS de inmediato. Por lo tanto, facilitaría el seguimiento de las impurezas de los medicamentos descubiertas durante el proceso y garantizaría su eliminación efectiva con la optimización y el control del proceso", dijo. Chen.
"Tal aparato nos permite separar péptidos después de la digestión de proteínas con cromatografía líquida, monitorear la oxidación de péptidos en la celda de flujo electroquímico para producir una corriente eléctrica y medir el rendimiento de oxidación con espectrometría de masas", explicó el primer autor del artículo y NJIT Ph.D. . estudiante Yongling Ai. "La combinación de señales de corriente eléctrica junto con el rendimiento de oxidación proporciona información suficiente para la cuantificación absoluta de péptidos y proteínas".
En su estudio, el equipo demostró su método CMS logrando la cuantificación absoluta de múltiples proteínas (β-lactoglobulina B, α-lactoalbúmina y anhidrasa carbónica) en una mezcla de una vez, sin usar ningún estándar.
En particular, el equipo también mostró las capacidades del método para detectar la desamidación de proteínas, un evento de degradación común en las proteínas terapéuticas que resulta del estrés físico o químico durante todo el proceso de fabricación y almacenamiento.
El equipo cuantificó con éxito varios productos de degradación de proteínas, incluido un intermedio clave de la degradación de proteínas, la formación de succinimida, que nunca antes se había hecho con una cuantificación absoluta debido a la falta de estándares, según los autores del estudio.
"La falta de estándares se debe a los desafíos en su síntesis de novo", dijo Chen. "Ser capaz de cuantificar con precisión los productos e intermedios de desamidación podría proporcionar una mejor comprensión de la degradación de proteínas terapéuticas y, potencialmente, crear una nueva forma de investigar patologías de enfermedades y procesos de envejecimiento".
Ahora, el laboratorio de Chen planea aplicar su nuevo método para la cuantificación a gran escala de miles de proteínas en una sola operación. También planean mejorar la sensibilidad de su análisis CMS para permitir la cuantificación de niveles muy bajos de proteínas en muestras biológicas complejas, lo que podría beneficiar los esfuerzos de investigación que van desde el diagnóstico clínico y el descubrimiento de fármacos hasta la medicina de precisión para la identificación y cuantificación de muestras a nivel molecular. es necesario.
"Como las proteínas realizan una amplia gama de funciones dentro de los organismos, es difícil exagerar la importancia de la cuantificación absoluta de proteínas", dijo Chen. "CMS debería acelerar los procesos de diagnóstico de enfermedades, descubrimiento y desarrollo de fármacos, y ahora abre una nueva puerta para que los biólogos y bioquímicos exploren cantidades de proteínas en el cuerpo humano que pueden cumplir importantes funciones biológicas o roles como biomarcadores de enfermedades y objetivos de fármacos. " Investigadores desarrollan una forma más fácil y rápida de cuantificar y explorar proteínas terapéuticas