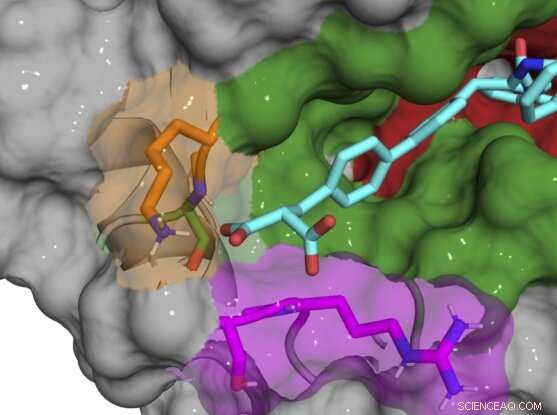
Estructura cocristalina de rayos X del compuesto B52 (cian) que se une e inhibe la proteína ciclofilina D. Crédito:Aziz Rangwala
La ciclosporina es uno de los medicamentos inmunosupresores más comunes y efectivos que se usan para tratar enfermedades crónicas como la artritis y la psoriasis, pero conlleva el riesgo de efectos secundarios graves. Los científicos creen que eso puede deberse a que el fármaco se dirige ampliamente a las ciclofilinas, una familia de 17 proteínas reguladoras que desempeñan diferentes funciones en la promoción de la salud celular. Aunque cada subtipo individual de ciclofilina tiene una función única, muchos fármacos inmunosupresores actuales se dirigen a toda la familia, lo que significa que importantes vías desconocidas pueden desactivarse o alterarse accidentalmente.
El problema se complica por el hecho de que el sitio activo donde se unen las moléculas es casi idéntico en las 17 ciclofilinas, lo que dificulta que los fabricantes de medicamentos apunten a subtipos específicos. En un artículo publicado hoy en Nature Chemical Biology , científicos en el laboratorio del miembro principal del Broad Institute, David Liu, quien también es director del Merkin Institute of Transformative Technologies in Healthcare en Broad, en colaboración con los laboratorios de Markus Seeliger en SUNY Stony Brook y el miembro del instituto Vamsi Mootha en Massachusetts General Hospital han propuesto una nueva solución.
En lugar de apuntar al sitio activo de las proteínas de ciclofilina, los investigadores del laboratorio de Liu describen un proceso que encuentra compuestos que se unen al "sitio exo", un pequeño bolsillo junto al sitio activo que varía en tamaño y forma en diferentes ciclofilinas. Utilizando proteínas aisladas en un tubo de ensayo, el equipo descubrió varios compuestos que se unen e inhiben exclusivamente la ciclofilina D (CypD), una proteína involucrada en la apertura y el cierre de los poros mitocondriales. También aplicaron principios similares para descubrir inhibidores selectivos únicos para la ciclofilina E (CypE). Los autores dicen que su estudio sienta las bases para que los científicos desarrollen inhibidores de ciclofilina selectivos de subtipo adicionales, algunos de los cuales pueden ser útiles como herramientas para la biología o como pistas para el desarrollo terapéutico.
"Es un nuevo modo de encuadernación que aprovecha un bolsillo que la gente aún no ha explorado por completo", dijo el autor principal Alex Peterson, ahora becario postdoctoral en el Instituto de Investigación Scripps, quien dirigió el proyecto como estudiante de posgrado en el laboratorio de Liu. . "Es una especie de modelo de cómo las personas pueden diseñar inhibidores selectivos de ciclofilina en el futuro".
Aprovechamiento de tecnologías nuevas y antiguas
CypD regula el poro de transición de permeabilidad mitocondrial (mPTP), pequeños poros ubicados en la superficie interna de las mitocondrias (conocido como el centro neurálgico de la célula). Cuando CypD detecta estrés oxidativo o niveles altos de calcio, se apresura a abrir el mPTP, lo que permite que el agua y otros iones entren y salgan de las mitocondrias.
Esta apertura de las compuertas mitocondriales puede convertirse en un problema con enfermedades como lesión por reperfusión de isquemia, diabetes, trastornos neurodegenerativos, enfermedades hepáticas y más. Dado que estas condiciones pueden causar niveles anormalmente altos de estrés oxidativo, CypD mantiene abiertos los poros mitocondriales durante más tiempo de lo habitual, lo que provoca disfunción mitocondrial, ruptura y muerte celular. Se ha pensado que los medicamentos que ralentizan e inhiben la reacción de CypD al alto estrés oxidativo podrían usarse para tratar una serie de enfermedades.
Para rastrear compuestos que se unen exclusivamente a CypD, el equipo recurrió a bibliotecas de moléculas pequeñas codificadas por ADN, una tecnología desarrollada hace más de veinte años como uno de los primeros proyectos en el entonces nuevo laboratorio de Liu. Los investigadores pueden usar las bibliotecas, que están llenas de cientos de miles de compuestos sintéticos unidos a códigos de barras de ADN únicos, para buscar moléculas que se unan a las proteínas deseadas. Al mezclar proteínas CypD aisladas y una colección de 256 000 compuestos únicos codificados por ADN en un tubo de ensayo, el equipo identificó cientos de compuestos prometedores.
La mayoría de los compuestos iniciales aún se unían en y alrededor del sitio activo, inhibiendo múltiples subtipos de ciclofilina, por lo que el equipo gradualmente realizó pequeños cambios químicos en sus compuestos para hacerlos exclusivos de CypD. Una vez que descubrieron que el sitio exo era la clave para desarrollar inhibidores específicos de subtipo, pudieron diseñar un par de compuestos que inhiben potentemente CypD mientras afectan mínimamente a otras ciclofilinas. Las estructuras cocristalinas de rayos X de la proteína CypD y los inhibidores durante el desarrollo le dieron al equipo una mirada entre bastidores a la ubicación precisa donde se unían sus moléculas.
Luego, los investigadores trataron las mitocondrias aisladas con sus dos compuestos principales y observaron que eran efectivos para ralentizar la apertura de los poros mitocondriales de CypD. Las imágenes especulares de sus compuestos, que no inhiben CypD, no mostraron actividad en las mitocondrias. Para demostrar que su éxito no fue un incidente aislado, repitieron la estrategia nuevamente para CypE, una ciclofilina responsable de regular el procesamiento del ARNm. Una vez más, desarrollaron un compuesto que lo atacó exclusivamente y dejó las 16 ciclofilinas restantes sin eliminar.
El equipo espera que sus hallazgos puedan, en última instancia, ayudar a los biólogos químicos y a los fabricantes de medicamentos a desarrollar medicamentos dirigidos a la ciclofilina mejores y más específicos. Incluso dieron una ventaja a los futuros científicos:debido a que los compuestos dirigidos a CypD luchan por ingresar a las células humanas por sí solos, el equipo los modificó agregando derivados de éster que evitan efectivamente la membrana plasmática y llegan a las mitocondrias.
"El trabajo de nuestro equipo finalmente nos permitió superar este problema de larga data:¿cómo se inhibe selectivamente solo un subtipo de ciclofilina de 17?" dijo Liu, quien también es investigador del Instituto Médico Howard Hughes. "En el futuro, las moléculas que provienen del uso de nuestra estrategia, espero, demostrarán ser útiles tanto para la ciencia básica como potencialmente para la terapéutica". Nueva estrategia de síntesis acelera la identificación de versiones más simples de un producto natural