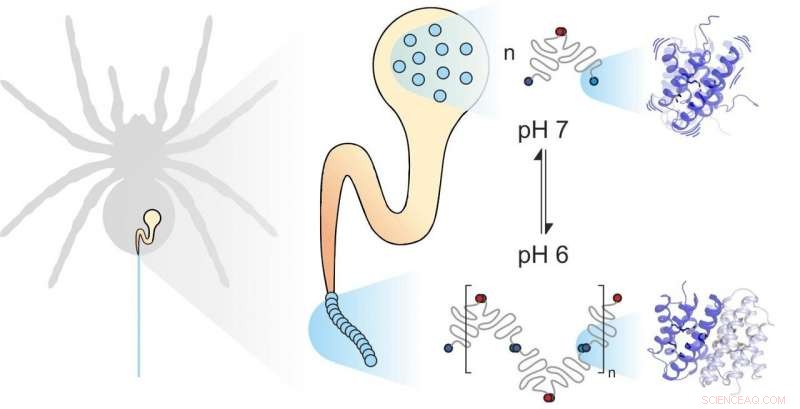
La seda de araña está compuesta de proteínas individuales. Los factores mecánicos y químicos influyen en cómo se ensamblan. La dinámica de las subunidades juega un papel importante. Crédito:Benedikt Goretzki, Ute Hellmich
La seda de araña se compone de proteínas formadoras de fibras, almacenado por la araña en una glándula especializada. Cuando la araña necesita seda por ejemplo, para crear una web, Extruye las proteínas de la seda a través de un largo conducto en el que se exponen a determinadas influencias mecánicas y químicas y se ensamblan para formar la seda. Proteínas de seda de araña, como todas las proteínas, constan de 20 bloques de construcción elementales conocidos como aminoácidos. El número y la secuencia de estos aminoácidos determina las propiedades de las proteínas individuales. Por ejemplo, si los aminoácidos hidrófobos como la leucina se encuentran en el centro de una proteína, el resultado es una estabilidad estructural considerable. Por lo tanto, es de esperar que la seda de araña extremadamente fuerte contenga mucha leucina. Para su sorpresa, sin embargo, Científicos de las universidades de Mainz y Würzburg descubrieron que otro bloque de construcción, metionina, es muy abundante en algunas proteínas de la seda de araña.
Se sabe que las cadenas laterales de metionina son muy flexibles. "Fue esta abundancia de metionina en la proteína de la seda de araña lo que nos hizo observar más de cerca su dinámica, ", dijo la profesora Ute Hellmich de la Universidad Johannes Gutenberg de Mainz (JGU)." Nuestra colaboración con el equipo del Dr. Hannes Neuweiler en Julius-Maximilians-Universität Würzburg (JMU) nos dio acceso a herramientas de investigación biofísica de última generación. "
El grupo de Würzburg sustituyó sistemáticamente el aminoácido metionina en las proteínas de la seda de araña con leucina y comparó el plegamiento, estabilidad, y dinámica de las variantes de proteínas resultantes con la ayuda de la espectroscopia de correlación de fluorescencia de transferencia de electrones fotoinducida (PET-FCS). El Dr. Hannes Neuweiler fue fundamental en el desarrollo de esta técnica, y su laboratorio es líder mundial en su uso para investigar sistemas biológicos. El equipo del profesor Ute Hellmich luego investigó la estructura y dinámica de las dos variantes de proteínas utilizando espectroscopía de resonancia magnética nuclear (RMN) de alta resolución. "Realizamos nuestras mediciones de RMN en el Centro de Resonancia Magnética Biomolecular de la Universidad Goethe de Frankfurt, otro ejemplo del potencial generado por nuestra cooperación en la red de la Universidad Rin-Meno, "enfatizó Hellmich.
Los bloques de construcción de metionina en las proteínas de la seda de araña brindan flexibilidad
La combinación de PET-FCS y espectroscopia de RMN llevó a los dos grupos de investigación a la inesperada conclusión de que la metionina en la proteína de seda de araña aumenta la flexibilidad de la estructura de la proteína. y que esta flexibilidad es precisamente lo que permite que las proteínas individuales de la seda de araña interactúen estrechamente. "Descubrimos que sustituir la metionina por leucina no tiene ningún efecto sobre la estructura de la proteína de la seda de araña. De hecho, ambas proteínas se ven exactamente iguales. Al mismo tiempo, sin embargo, la proteína natural que contiene metionina se une mucho más fuertemente a otras proteínas de la seda de araña. La proteína que contiene leucina que sintetizamos en el laboratorio pierde en gran medida esta capacidad para formar enlaces tan estables, "señaló Benedikt Goretzki, candidato a doctorado en el equipo de Hellmich y uno de los dos autores principales del estudio publicado en Comunicaciones de la naturaleza . "Estábamos realmente asombrados, ya que esto muestra que no es solo la forma de una proteína lo que determina cómo funciona, sino también, en un grado considerable, su flexibilidad ".
"La metionina no solo hace que la proteína sea más dinámica, también mejora su funcionalidad. En efecto, permite que dos proteínas se interconecten específicamente entre sí, que de otro modo sería imposible, incluso si tuvieran la misma estructura, "aclaró Julia Heiby, candidato a doctorado en el grupo de Neuweiler y el otro autor principal del estudio.
"La forma sigue a la función" es una regla empírica en biología estructural. En otras palabras, lo que hace una proteína normalmente se puede deducir de su estructura tridimensional. "Es impresionante cómo la naturaleza también puede influir en la función de las proteínas al adaptar con precisión su dinámica, ", añadió la profesora Ute Hellmich, bioquímica de Mainz.
Sobre la base de estos hallazgos, ahora puede ser posible modificar selectivamente las propiedades de las proteínas de la seda de araña, por ejemplo, para sintetizar nuevos biomateriales altamente estables. Además, los dos grupos también esperan proporcionar conocimientos generales sobre la relevancia de la dinámica de las proteínas en relación con sus funciones biológicas. "La dinámica de las proteínas es importante en todos los aspectos de la vida, "concluyó Hellmich." Esto es cierto tanto para las arañas como para los humanos ".