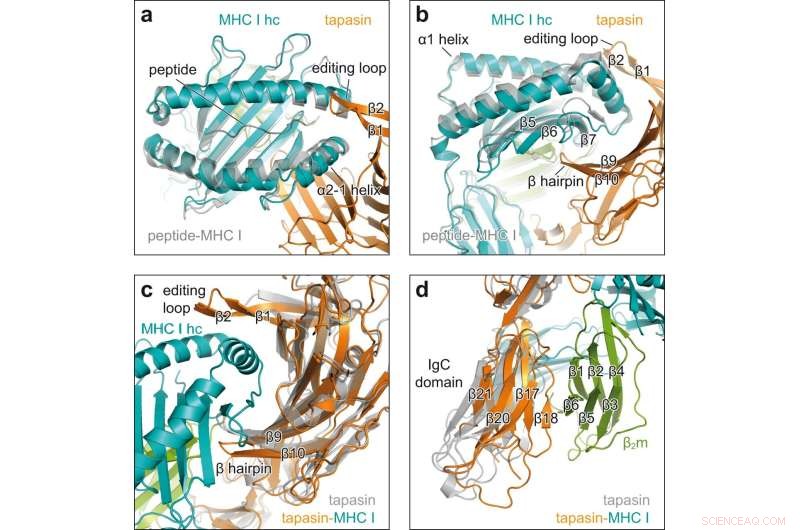
Cambios conformacionales sobre el compromiso cliente-acompañante. a Vista superior del MHC I receptor de péptido superpuesto en el complejo chaperona (MHC I hc, verde azulado; tapasina, naranja) con H2-D unida a péptido b (gris, PDB ID 2F74) en representación de dibujos animados. hc cadena pesada; Hebras β1, β2, β del bucle de edición de tapasina. b Vista lateral de la superposición que se muestra en cadenas β5, β6, β7, β de MHC I hc; β9, β10, β horquilla de tapasina. c Vista de la interfaz cóncava de la tapasina en superposición de la tapasina unida a MHC I del complejo chaperón (tapasina, naranja; MHC I hc, verde azulado; β2m, verde) con tapasina sin cliente (gris, PDB ID 3F8U). d Superposición como en c pero vista en el dominio C-terminal de tapasina. Dominio constante de inmunoglobulina de dominio IgC, β2 m β2 -microglobulina. Crédito:Comunicaciones de la naturaleza (2022). DOI:10.1038/s41467-022-32841-9
Como grupos de trabajo del sistema inmunitario adaptativo, los linfocitos T son responsables de atacar y eliminar las células infectadas o cancerosas. Tales células, como casi todas las células del cuerpo humano, presentan en su superficie fragmentos de todas las proteínas que producen en su interior. Si estos incluyen péptidos que un linfocito T reconoce como extraños, el linfocito se activa y mata la célula en cuestión.
Por lo tanto, es importante para una respuesta sólida de las células T que se presenten fragmentos de proteínas adecuados a los linfocitos T. El equipo de investigación dirigido por Simon Trowitzsch y Robert Tampé del Instituto de Bioquímica de la Universidad Goethe de Frankfurt ahora ha arrojado luz sobre cómo la célula selecciona estos fragmentos de proteínas o péptidos.
La presentación de péptidos tiene lugar en las denominadas moléculas del complejo principal de histocompatibilidad de clase I (MHC I). Las moléculas MHC I son un grupo de proteínas de superficie muy diversas que pueden unirse a miríadas de péptidos diferentes. Están anclados en la membrana celular y forman un bolsillo de unión de péptidos con su parte orientada hacia el exterior.
Como todas las proteínas de superficie, las moléculas MHC I toman la llamada ruta secretora:se sintetizan en el sistema de cavidades de la célula (retículo endoplásmico (ER) y aparato de Golgi) y se pliegan allí. Luego, pequeñas vesículas brotan del sistema de cavidades, migran a la membrana celular y se fusionan con ella.
El proceso de maduración de las moléculas del MHC I está muy estrictamente controlado:en el RE, las proteínas conocidas como "chaperones" las ayudan a plegarse. La chaperona tapasina es esencial para la carga de péptidos en este proceso.
"Cuando una molécula de MHC I se une a un péptido, la tapasina verifica qué tan fuerte es la unión", dice Trowitzsch, explicando la tarea de la chaperona. "Si el enlace es inestable, el péptido se elimina y se reemplaza por uno que se une fuertemente". Sin embargo, aún no ha sido posible aclarar cómo tapasin realiza exactamente esta tarea, especialmente porque el proceso de carga es extremadamente rápido.
Los bioquímicos y biólogos estructurales de la Universidad Goethe de Frankfurt ahora han logrado por primera vez visualizar la interacción de corta duración entre la chaperona y la molécula MHC I por medio del análisis de la estructura de rayos X.
Para ello, produjeron variantes de los dos compañeros de interacción que ya no estaban incrustados en la membrana, los purificaron y los unieron. Un truco ayudó a capturar el complejo de carga en acción para la cristalización:primero, el equipo de investigación cargó la molécula MHC I con un péptido de alta afinidad para que se creara un complejo estable.
Una señal de luz desencadenó la escisión del péptido, lo que redujo en gran medida su capacidad para unirse a la molécula MHC I. Inmediatamente, la tapasina entró en escena y quedó unida a la molécula MHC I que carece de su péptido. "La escisión fotoinducida del péptido fue fundamental para el éxito de nuestro experimento", dice Tampé. "Con la ayuda de esta biología optoquímica, ahora podemos reproducir sistemáticamente procesos celulares complejos uno por uno".
El análisis de la estructura de rayos X de los cristales reveló cómo la tapasina ensancha el bolsillo de unión de péptidos de la molécula MHC I, probando así la fuerza del enlace peptídico. Para ello, los socios de interacción forman una gran área de contacto; para la estabilización, un lazo de tapasina se asienta sobre el bolsillo de unión ampliado.
"Esta es la primera vez que mostramos el proceso de carga en alta resolución", dice Tampé. Las imágenes también revelan cómo una sola chaperona puede interactuar con la enorme diversidad de moléculas MHC I, dice el bioquímico. "Tapasin se une precisamente a las regiones no variables de las moléculas MHC I". Sin embargo, la nueva estructura no solo mejora nuestra comprensión de los complejos procesos involucrados en la carga de moléculas MHC I. También debería ayudar a seleccionar candidatos adecuados para el desarrollo de vacunas.
La investigación fue publicada en Nature Communications . Señales de tráfico para las células de defensa inmunitarias