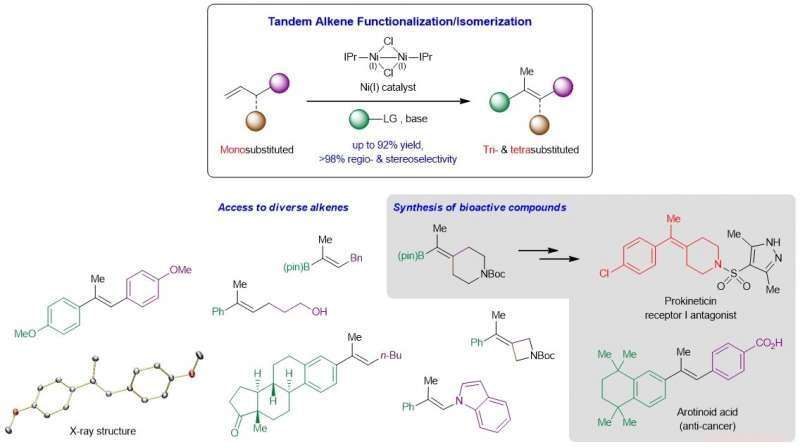
Esquema que muestra el desarrollo de un nuevo sistema catalizado por Ni que convierte olefinas monosustituidas baratas y fácilmente disponibles en análogos trisustituidos y tetrasustituidos de alto valor. y su aplicación a la síntesis de compuestos bioactivos complejos. Crédito: Catálisis de la naturaleza / Universidad Nacional de Singapur
Los químicos de NUS han desarrollado una nueva forma de acceder a los preciados alquenos tri y tetrasustituidos a través de un proceso en tándem catalizado por níquel que implica una reacción de Heck seguida de una migración de doble enlace carbono-carbono (C =C).
El desarrollo de métodos fiables que proporcionen alquenos acíclicos tri- y tetrasustituidos estereoquímicamente definidos es un objetivo de larga data en la síntesis orgánica. Estos enlaces C =C altamente sustituidos comúnmente residen en innumerables moléculas de interés, incluidos materiales orgánicos y entidades biológicamente activas, y son productos intermedios clave para una posterior derivación a un espectro más amplio de productos de alto valor. Las reacciones existentes que convierten compuestos de carbonilo o enlaces carbono-carbono insaturados en olefinas tri- y tetrasustituidas a menudo implican largas rutas sintéticas, exhiben compatibilidad limitada de grupos funcionales, Sufre de un control de regio- o estereoselectividad insatisfactorio, y / o no son suficientemente generales. Una complicación surge de la pequeña diferencia de energía entre los cis y trans isómeros de estos alquenos altamente sustituidos, lo que aumenta la dificultad de generar estos compuestos en alta estereoselectividad.
Un equipo de investigación dirigido por el profesor Koh Ming Joo, del Departamento de Química, Universidad Nacional de Singapur en colaboración con el profesor Osvaldo Gutiérrez, de la Universidad de Maryland, ha concebido una estrategia en tándem que fusiona la reacción de Heck regiocontrolada y la migración de enlaces C =C estereocontrolada en un solo paso (ver Figura). Los estudios mecanicistas y computacionales mostraron que la reacción procede a través de una vía no radical, y que tanto la considerable base de alcóxido y norte -Ligando de carbeno heterocíclico (NHC) son cruciales para el proceso catalítico.
El profesor Koh dijo:"Nuestra incursión inicial en esta área de investigación fue preguntarnos hipotéticamente cómo podemos transformar α-olefinas monosustituidas, una clase muy abundante de materias primas químicas, a los análogos trisustituidos y tetrasustituidos más valiosos pero difíciles de sintetizar, en un solo proceso. Como resulta, la solución a esto fue diseñar una reacción en tándem que primero reacciona con el sustrato monosustituido, luego lo isomeriza al producto deseado. Un control bien orquestado de la regio y la estereoselectividad fue primordial, lo que nos llevó a descubrir la eficacia única de los catalizadores de níquel ligados a NHC ".
"Esperamos que nuestra nueva metodología mejore la forma en que se sintetizan muchas moléculas bioactivas, y servir como modelo para el diseño de transformaciones catalíticas en tándem para construir importantes bloques de construcción a partir de materiales no preciosos, "añadió el profesor Koh.
El equipo de investigación planea explotar los conocimientos obtenidos de este trabajo para desarrollar nuevas transformaciones en tándem para facilitar la síntesis química fina.