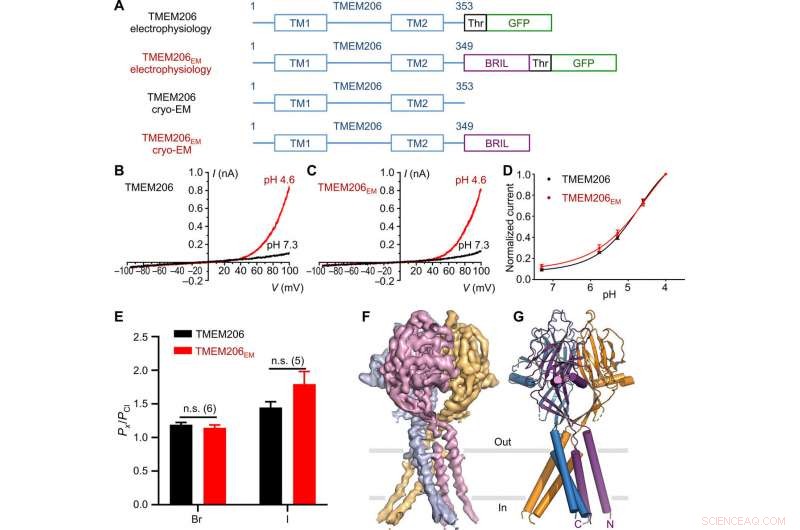
Función y estructura del pez globo TMEM206. (A) Esquema de las construcciones de canales utilizadas para experimentos de electrofisiología y crio-EM de una sola partícula. "Thr" representa un sitio de escisión de trombina. (B y C) Trazas de corriente de células completas representativas activadas por pH extracelular 4,6 para el pez globo TMEM206 (B) y TMEM206EM (C). Las construcciones de canal se expresaron en células 293T de riñón embrionario humano (HEK) inactivas para TMEM206. (D) Relaciones normalizadas de corriente a pH de pez globo TMEM206 (n =6 a 9 células por punto de datos) y TMEM206EM (n =5 a 6 células por punto de datos). Todas las corrientes se registraron a temperatura ambiente y se normalizaron a corrientes de pH 4,0 a +100 mV. (E) Selectividad aniónica para pez globo TMEM206 y TMEM206EM. Los datos se presentan como medias ± SEM (n.s., insignificante; Prueba t de Student). (F) Densidad crio-EM del pez globo TMEM206EM contorneado a 7,0 σ y coloreado por subunidades individuales. (G) Estructura trimérica del pez globo TMEM206EM. Crédito: Avances de la ciencia , doi:10.1126 / sciadv.abe5983
La proteína transmembrana 206 abreviada como TMEM206 es un canal de cloruro conservado evolutivamente que subyace al expresado ubicuamente, activado por protones, Corrientes aniónicas rectificadoras hacia el exterior. En un nuevo informe ahora publicado en Avances de la ciencia , Zengqin Deng y un equipo de investigación multidisciplinario de la Facultad de Medicina de la Universidad de Washington, en Saint Louis, U.S. describió la estructura de microscopía crioelectrónica (crio-EM) del pez globo TMEM206. La estructura formó un canal trimérico con dos segmentos transmembrana y un gran dominio extracelular. De acuerdo a los resultados, Deng y col. mostró cómo se podía acceder lateralmente a un amplio vestíbulo en la región extracelular desde tres portales laterales, donde el poro central contenía múltiples construcciones. Por ejemplo, un residuo de lisina conservado cerca de la región citoplásmica de la hélice interna, presumiblemente formó el filtro de selectividad de iones cloruro. La estructura y el ensamblaje del núcleo se parecían a los de los canales de sodio que no están relacionados en la secuencia de aminoácidos, y por lo tanto conducen cationes en lugar de aniones. Junto con la electrofisiología, proporcionaron información sobre la conducción de iones y la compuerta para una nueva clase de canales de cloruro que son arquitectónicamente distintos de las familias de canales de cloruro descritas anteriormente.
Canales de iones de cloruro
Los iones de cloruro son aniones abundantes en los animales, y se mueven a través de las membranas celulares a través de canales de cloruro y transportadores para una variedad de funciones celulares, incluida la regulación del volumen celular, acidificación intracelular y control de la excitabilidad en los músculos. Los iones se observan ampliamente en células de mamíferos, aunque los componentes moleculares detrás de las corrientes de cloruro han permanecido esquivos hasta ahora. Dos estudios independientes que utilizaron el cribado de interferencia de ARN en todo el genoma habían identificado TMEM206 como el canal aniónico subyacente. El TMEM206 se conserva evolutivamente en vertebrados. Los canales de cloruro son diversos tanto en la secuencia de aminoácidos como en la arquitectura tridimensional. En este trabajo, Deng y col. presentaron una estructura de microscopía crioelectrónica (crio-EM) de pez globo TMEM206 para revelar una arquitectura de canal trimérico diferente a las conocidas anteriormente. Los científicos combinaron la electrofisiología con este trabajo para proporcionar la primera descripción estructural y funcional de un canal de cloruro conservado evolutivamente y ampliamente expresado para establecer un marco molecular y comprender la conducción de cloruro y la compuerta del canal.
Estructura de subunidades y montaje de canales. (A) Estructura de una sola subunidad, mostrando el dominio transmembrana (rojo), dominio β interno (azul), dominio β externo (naranja), y HTH (verde). Se indican los elementos de la estructura secundaria. (B) Conjunto de canal trimérico. Dos de las subunidades se muestran en representación de superficie. (C) Vista ortogonal como en (B), desde el lado extracelular. Crédito: Avances de la ciencia , doi:10.1126 / sciadv.abe5983 
Los investigadores utilizaron construcciones etiquetadas con proteínas fluorescentes verdes para identificar candidatos a TMEM206 y seleccionaron el pez globo TMEM206 debido a su identidad de secuencia compartida al 50 por ciento con el canal de cloruro humano. Deng y col. luego purificó la proteína TMEM206 de pez globo de tipo salvaje de longitud completa y la sometió a análisis crio-EM de una sola partícula. Usando mapas de reconstrucción 3D, revelaron una arquitectura de canal trimérico con dominios transmembrana y extramembrana. El TMEM206 formó un trímero simétrico, donde cada subunidad contenía un dominio transmembrana (TMD) con dos hélices que atraviesan la membrana llamadas TM1 y TM2 y un gran dominio extracelular (ECD) enriquecido con dominios β con motivos adicionales organizados en las capas superior e inferior. Adicionalmente, Los contactos extensos de la cadena lateral estuvieron involucrados a través de interacciones de van der Waals en los dominios β interno y externo. El ensamblaje del canal trimérico introdujo tres aberturas laterales o portales laterales en el medio de la región extracelular para facilitar probablemente el paso de iones y agua. Los portales laterales alargados se extendían hasta la unión ECD-TMD para reanudar las interacciones de empaquetamiento estrecho. Para superar cualquier dificultad técnica para determinar la estructura de la proteína, Deng y col. fusionó el C-terminal de la proteína de tipo transmembrana inducida por interferón restringido al hueso (abreviado BRIL); una proteína de haz de cuatro hélices ampliamente utilizada como chaperona de cristalización para mejorar la estabilidad de la membrana y promover la formación de cristales.
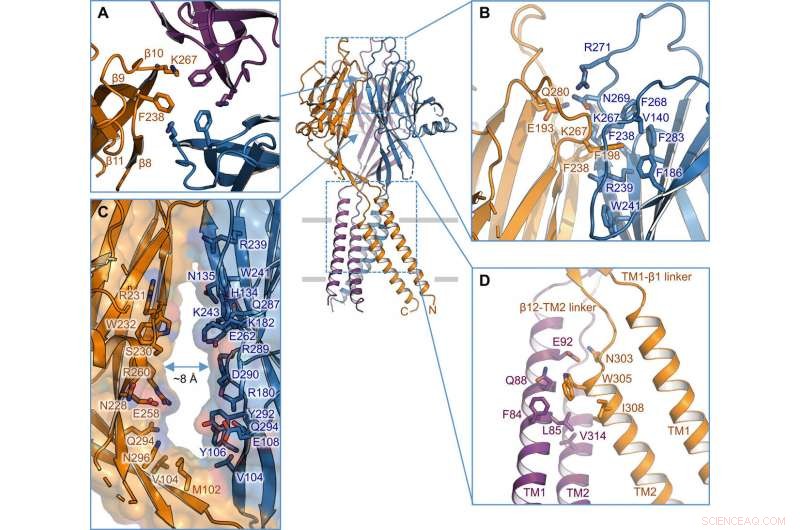
Interfaz intersubunidad. (A) Interfaz trimérica en el vértice del ECD. Se resaltan las cadenas laterales de K267 y F238. (B) Vista lateral de la interfaz entre subunidades en la capa superior del ECD. Los residuos involucrados en la interfaz se muestran en representación de barra. (C) Portal lateral en el medio del ECD entre dos subunidades vecinas. Se ilustra la superficie y los residuos que recubren la pared. (D) Interfaz intersubunidad TM1-TM2. Crédito: Avances de la ciencia , doi:10.1126 / sciadv.abe5983
Estudios de la vía de permeación de iones y mutagénesis
Usando cálculos de radio de poro, Deng y col. mostró cómo el poro central de conducción de iones contenía múltiples constricciones para evitar el paso de los iones. La estructura representó una conformación no conductora debido a las condiciones de tampón de pH alto (pH 8,0) utilizadas para determinar la estructura crio-EM. Se podía acceder lateralmente al voluminoso y alargado vestíbulo central debido a la falta de contactos proteína-proteína en el dominio extracelular. El punto estrecho del canal de proteínas no interfirió con la conducción de iones y podría mantenerse durante el ciclo de activación del canal cuando los iones pasaron a través de los tres portales laterales. El potencial electrostático ligeramente positivo de las paredes interiores del vestíbulo central y las entradas laterales también facilitó la atracción de iones de cloruro. En la unión dominio extracelular-dominio transmembrana (ECD-TMD), tres hebras conectadas a las hélices externas y se movieron hacia adentro para unirse a las hélices internas para generar una puerta extracelular por encima de la capa de bilípidos. Las construcciones consecutivas en las posiciones enfrentadas a los poros formaron una puerta hidrófoba que podría prohibir la conducción de iones.
Para respaldar los hallazgos estructurales, Deng y col. realizó estudios de mutagénesis en residuos clave de vida porosa. Cuando sustituyeron los residuos básicos conservados con alanina o residuos ácidos, se suprimieron las corrientes de cloruro activado por ácido. A diferencia de, Las sustituciones de arginina retuvieron la función del canal para respaldar aún más el requisito de cargas positivas en el filtro selectivo de aniones. Por ejemplo, el dominio I310 formó un componente crítico de la puerta transmembrana y otra estructura conocida como K320 formó el filtro de selectividad aniónica. El trabajo apoyó la conservación estructural entre los ortólogos humanos y de pez globo para representar un modelo fisiológicamente relevante para los canales de cloruro.
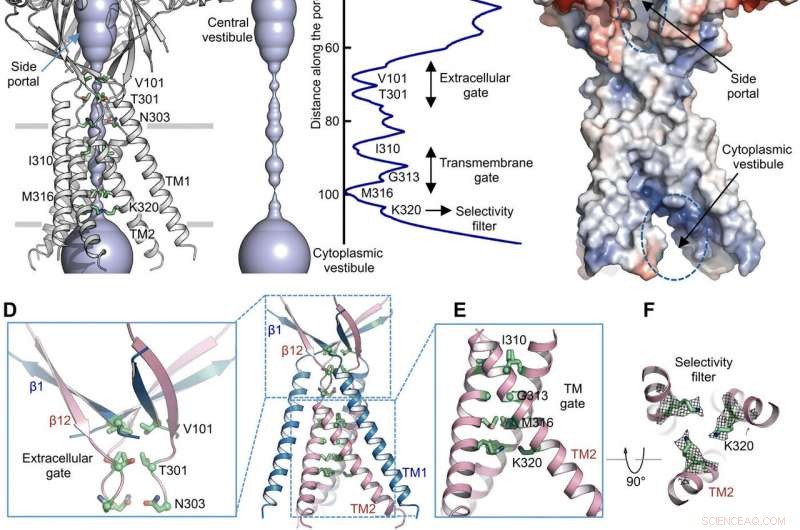
Vía de permeación de iones. (A) Estructura de TMEM206EM y el poro de conducción de iones central, se muestra en la representación de la superficie. Los residuos que generan constricciones se resaltan y etiquetan. Se indica el portal lateral. (B) Poro de conducción de iones central y estimación del radio (panel derecho). (C) Representación de la superficie del canal, coloreado por el potencial electrostático de la superficie (rojo, −5 kT / e; blanco, neutral; azul, +5 kT / e). Se indican el portal lateral y el vestíbulo citoplasmático. (D) Puerta extracelular en la unión ECD-TMD. V101, T301, y N303 se muestran en representación de barra. (E) Puerta transmembrana, constituido por I310, G313, y M316. (F) Filtro de selectividad putativo definido por K320. También se muestran las densidades de cadena lateral para K320, contorneado a 6,5 σ. (G y H) Densidades de corriente con un pH extracelular de 7,3 (G) y 4,6 (H) a +100 mV para mutantes TMEM206. Las corrientes de la membrana de la célula completa se registraron utilizando una rampa de voltaje de -100 a +100 mV durante 500 ms a un potencial de retención de 0 mV. (I) Relación de densidad de corriente a pH 4,6 a pH 7,3. Crédito: Avances de la ciencia , doi:10.1126 / sciadv.abe5983
Convergencia estructural
La topología, La estructura y el ensamblaje de TMEM206 representaron los de la superfamilia de canales iónicos de canales epiteliales de sodio (ENaC) / degenerina, incluidos los canales iónicos sensibles al ácido (ASIC); a pesar de la falta de una homología de secuencia de aminoácidos distinta entre los dos canales. Los canales triméricos para iones de sodio y cloruro con carga opuesta, sin embargo, compartía una estructura de núcleo común flanqueada por dos hélices transmembrana. El equipo observó cómo la puerta extracelular entre el vestíbulo central y el poro transmembrana podría expandirse para pasar iones después de la activación del canal. Si bien los canales de sodio epiteliales podrían activarse liberando péptidos inhibidores a través de la proteólisis en el dominio extracelular, los ASIC y TMEM206 solo podrían activarse mediante protones extracelulares. Las características estructurales conservadas entre TMEM y AS1CS también sugirieron cambios conformacionales de compuerta análogos para las dos moléculas.
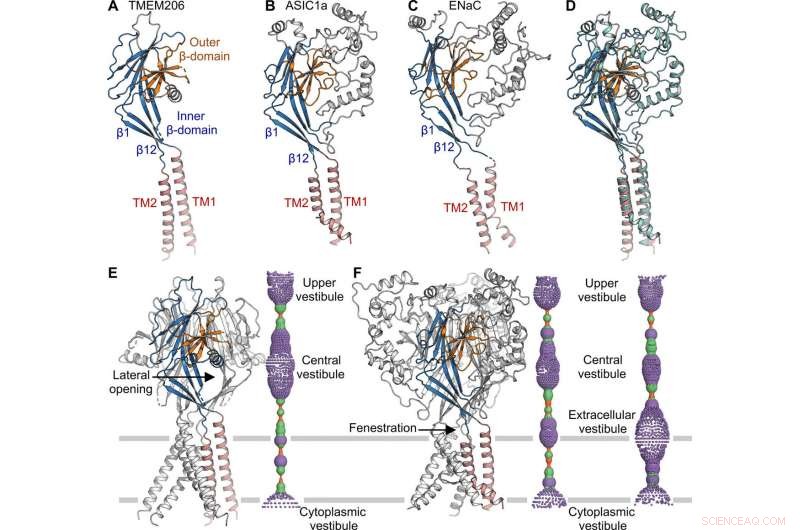
Comparación estructural con ASIC y ENaC. (A a C) Estructuras de subunidades de TMEM206 (A), ASIC1a [Banco de datos de proteínas (PDB):6AVE] (B), y ENaC (PDB:6BQN) (C). Los dominios tienen un color similar. (D) Superposición de TMEM206, coloreado como en (A), y ASIC1a coloreado en cian. (E) Canal trimérico TMEM206 y su poro central de conducción de iones. El poro se estima utilizando el programa HOLE y se representa como puntos de colores (radio de poro:rojo <1,15 Å
panorama
De este modo, Zengqin Deng y sus colegas utilizaron crio-EM de una sola partícula para determinar la estructura de las proteínas integrales de la membrana que normalmente son inalcanzables mediante la cristalografía de rayos X tradicional. Sigue siendo un desafío técnico significativo lograr una resolución casi atómica para proteínas de membrana de tamaño pequeño debido al bajo contraste y las relaciones señal / ruido. Deng y col. obtuvo una estructura de resolución de 3,5 angstrom de un canal fusionando una pequeña chaperona de cristalización BRIL para mejorar la estabilidad de las proteínas de membrana que de otro modo serían subóptimas para promover el empaquetamiento de cristales. Basado en la estructura central conservada, los canales fueron selectivos para cationes o aniones y experimentaron cambios conformacionales de compuerta similares. El trabajo estableció una nueva clase de canales de cloruro para formar un nuevo marco para futuras investigaciones funcionales y mecánicas en biología celular y estructural.
© 2021 Science X Network