© Wiley-VCH. Crédito:Angewandte Chemie International Edition doi.org/10.1002/anie.202100494
Las baterías se cargan y recargan, aparentemente todo gracias a una interacción perfecta entre el material del electrodo y el electrolito. Sin embargo, para una función de batería ideal, la interfase de electrolitos sólidos (SEI) juega un papel crucial. Los científicos de materiales ahora han estudiado la nucleación y el crecimiento de esta capa en detalle atómico. Según el estudio publicado en la revista Angewandte Chemie , las propiedades de los aniones y las moléculas de disolvente deben estar bien equilibradas.
En baterías de iones de litio, el SEI se forma al comienzo del primer proceso de carga, cuando se aplica un potencial. Los elementos del electrolito se depositan en el electrodo de grafito y forman un recubrimiento que pronto cubre todo el electrodo. Solo después de que se complete esta capa, ¿Pueden los iones de litio positivos intercalar en el electrodo sin exfoliar el material del electrodo?
Qiang Zhang y colegas de la Universidad de Tsinghua, Beijing, Porcelana, ahora hemos examinado más de cerca la formación de núcleos y el crecimiento del SEI. El electrolito de las baterías de iones de litio contiene sal de litio y un disolvente. Los disolventes fuertemente solvatantes envuelven el ion de litio, y los aniones flotan libremente. A diferencia de, los electrolitos de solvatación débil permiten una unión más estrecha de los aniones al ion litio. Aquí, los aniones siguen siendo parte de la capa de solvatación interna.
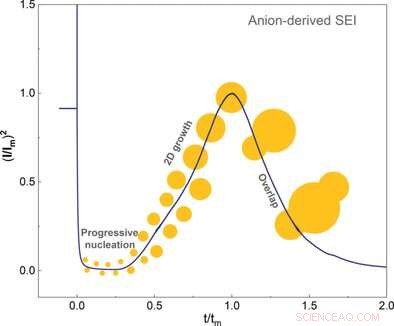
Esta capa de solvatación interna debe separarse del litio para permitir la formación y el crecimiento de SEI. Los investigadores demostraron que los aniones de la capa interna primero se adsorbieron en el electrodo nuevo y luego tomaron dos electrones en una reacción electroquímica. Este último evento desencadenó la descomposición y nucleación del SEI. Los autores concluyeron que la formación de SEI dependía principalmente de la facilidad con la que los aniones pueden agarrar electrones y descomponerse en comparación con el solvente.
Los científicos utilizaron técnicas electroquímicas y microscopía de fuerza atómica para investigar el crecimiento de los cristales hasta completar la capa. Descubrieron que solo se formaba una capa lisa con sobrepotenciales bajos. El solvente también influyó en el sobrepotencial. Los autores también observaron que los disolventes que tienen una alta afinidad por la capa cristalina no producen ningún sobrepotencial en absoluto.
Llegaron a la conclusión de que los diseños futuros de electrodos de alto rendimiento deberían centrarse más en la interacción entre los iones negativos de la sal de litio y el disolvente. Para permitir un inorgánico homogéneo, SEI cristalino que se formará, los aniones deben competir con el solvente; deberían adsorberse más fácilmente en la superficie del electrodo y emprender reacciones electroquímicas. Además, los productos de descomposición deben ser sólidos e insolubles, pero aún muestran cierta afinidad por el solvente, dijeron los autores.