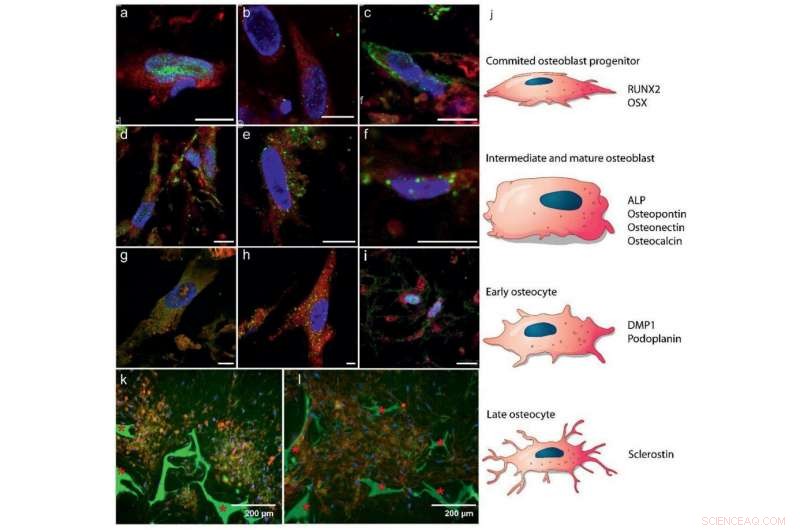
Diferenciación de hBMSC en osteoblastos y osteocitos:a – i) Imágenes de inmunohistoquímica de fluorescencia que muestran marcadores para a – c) primeras etapas de formación de osteoblastos, d – f) osteoblastos maduros, y g – i) desarrollo de osteocitos (5,55 mm de glucosa). Código de color:citoplasma de glóbulos rojos, azul - núcleos celulares, verde:a) RUNX2 (día 7), b) OSX (día 7), c) ALP (día 26), d) osteocalcina (día 26), e) osteopontina (día 26), f) osteonectina (día 21), g) DMP1 (día 28), h) podoplanina (día 28), e i) esclerostina (día 28). Barras de escala:10 µm. Vea la Figura S4, Información de soporte, para canales separados. j) Ilustración esquemática de la diferenciación de las MSC en osteoblastos y osteocitos, indicando en qué estado se espera la expresión de la proteína en a – i. k, l) Imágenes fluorescentes que indican dominios autoorganizados de osteocitos incrustados en una matriz mineralizada después de 8 semanas (25 mm de glucosa), k) co-localización de osteocitos (esclerostina, rojo) y mineral (calceína, verde), yl) colágeno (CNA35, rojo) y mineral (calceína, verde) * Indica el andamio de fibroína de seda.
Imagínese el uso de células madre de su médula ósea para hacer crecer un trozo de tejido óseo en el laboratorio, después de lo cual los médicos exploran qué medicamentos tienen el efecto deseado en los huesos. De este modo, se haría un plan de tratamiento a medida para todos, con el mejor enfoque claro de antemano:la medicina personalizada en su máxima expresión.
Esa visión del futuro ya no es ciencia ficción ahora que los investigadores de la Universidad de Tecnología de Eindhoven y el centro médico de la Universidad de Radboud se han dado cuenta de la primera parte:hacer crecer una pieza realista de tejido óseo a partir de células madre humanas. Es el primer organoide de hueso, una versión simplificada del original, los investigadores informan hoy en la revista Materiales funcionales avanzados .
Imagen coherente
"Con este, nosotros presentamos, por primera vez, la imagen completa de la formación ósea en etapa temprana, "dice Sandra Hofmann, profesor asociado de Bioingeniería Ósea de TU / e. Y eso es de gran importancia:cómo se forman nuestros huesos sigue siendo en gran parte un misterio. El hueso es un material muy complejo en el que interactúan innumerables células y procesos, y comprende una ingeniosa matriz de colágeno y mineral para aportar fuerza. Se sabe mucho sobre los componentes individuales, pero hasta ahora ha faltado una imagen coherente.
Tres tipos de células juegan el papel principal en la formación de hueso:osteoblastos (que forman tejido óseo), osteoclastos (que eliminan el hueso) y osteocitos (que regulan la formación y degradación del hueso). "La mayoría de los estudios hasta ahora se han centrado en uno de estos tipos de células, pero esa no es una buena representación del tejido real, ", dice Hofmann." Presentamos aquí una pieza de hueso tejido (hueso en etapa temprana) que se desarrolló a partir de células madre y contiene dos tipos de estas células:osteoblastos y osteocitos. Ahora vemos que podemos hacer huesos reales exclusivamente con estos dos tipos de células ".
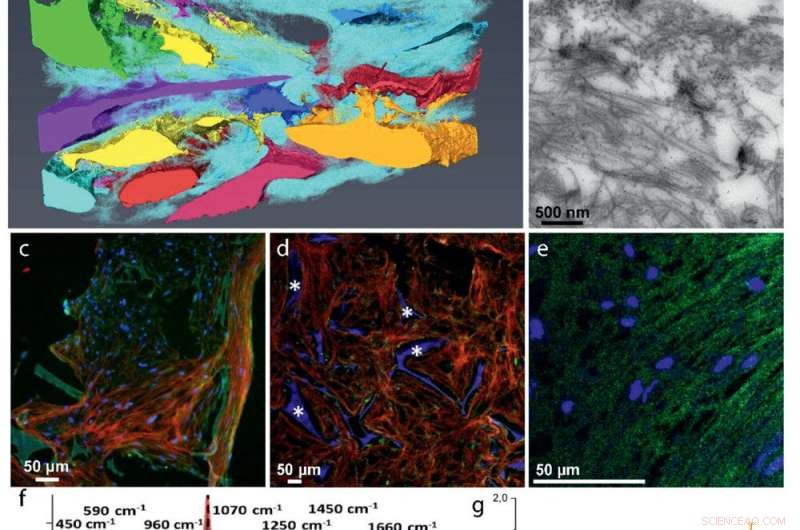
Desarrollo ECM:a) La reconstrucción 3D FIB / SEM muestra la incrustación de las células en la matriz de colágeno (cian). Las celdas discretas se representan con diferentes colores. b) Imagen TEM de una sección de 70 nm que muestra la distribución aleatoria de las fibrillas de colágeno. El colágeno de tipo I se identificó mediante inmunomarcaje. c – e) Inmunohistoquímica fluorescente que identifica proteínas no colágenas clave en la matriz colágena:c) Co-localización de osteocalcina (verde) y colágeno (rojo). d) Distribución de osteopontina (verde) en la matriz de colágeno (rojo). * Indica el andamio de fibroína de seda. e) Co-localización de DMP1 (verde) con la estructura de colágeno (ver Figura S5, Información de soporte, para la imagen de colágeno). f – g) Microespectrometría Raman de matrices mineralizadas. f) Espectros Raman localizados de colágeno mineralizado de hueso de pez cebra en desarrollo (rojo), el cocultivo osteogénico 3D (azul), y hueso humano de una hembra de 10 años (g gris) Proporciones mineral / matriz derivadas de Raman de 4 tejidos mineralizados de pez cebra (N =6, rojo), Cultivo osteogénico 3D (N =7, verde), Hembra humana de 10 años (N =1, gris), y hombre humano de 48 años o más (N =7, negro, tomado de la ref. [36]). Las barras indican las desviaciones estándar de la muestra. h) Presentación del mapa de calor de una sección transversal 3D FIB / SEM que muestra fibrillas de colágeno desorganizadas con diferentes grados de mineralización (Figura S10, Información de soporte). Las puntas de flecha indican fibrillas de colágeno no mineralizado (azul claro), la flecha indica fibrilla de colágeno mineralizado (naranja). i) Imagen TEM que muestra fibrillas de colágeno mineralizadas individuales.
Haciéndose más sabio con el empuje molecular
"Y quizás lo más importante, nuestro sistema se comporta como un hueso en una etapa temprana, "dice Anat Akiva, profesor asistente de Biología Celular en Radboudumc. "Demostramos que ambos tipos de células producen las proteínas que necesitan para su funcionalidad, y mostramos con el mayor detalle que la matriz en realidad es la matriz ósea que vemos en el tejido real ".
El hecho de que ahora sea posible una representación simplificada de la formación de hueso a nivel molecular ofrece posibilidades sin precedentes, según los investigadores. "Un hueso consta de un 99% de colágeno y minerales, pero también hay otro 1% de proteínas que son esenciales para la formación ósea exitosa, "explica el profesor Nico Sommerdijk de Radboudumc." Entonces, ¿cuál es el papel de estas proteínas? ¿Cómo apoyan la formación ósea? Nunca antes habíamos podido observar los hitos de este proceso a nivel molecular ".
Y con eso, inmediatamente tienen una buena entrada para investigar la causa de enfermedades óseas genéticas como la "enfermedad de los huesos quebradizos" y sus posibles tratamientos. "Recuerde que el origen de muchas enfermedades está a nivel molecular, al igual que el tratamiento, "dice Akiva." De hecho, ahora tenemos un sistema simple en un entorno confiable en el que podemos hurgar y ver cómo reaccionan las células óseas a los estímulos que proporcionamos ".